Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання)
Кожен оксид має свою назву. Хімічна назва оксидів складається з двох слів. Першим ставиться назва відповідного елемента, а другим – слово «оксид». Якщо елемент має одне значення валентності, то він утворює один оксид. Наприклад, SiO2 – силіцій оксид, Al2O3 – алюміній оксид, CaO – кальцій оксид. Якщо елемент має змінну валентність, то він може утворювати кілька оксидів. Тоді в назвах оксидів вказується валентність елемента. Наприклад, SO2 – сульфур(ІV) оксид, SO3 – сульфур(VІ) оксид, СО – карбон(ІІ) оксид, СО2 – карбон(IV) оксид.
Деякі оксиди крім хімічної назви мають тривіальні назви, наприклад, СаО – негашене вапно, СО – чадний газ, СО2 – вуглекислий газ, SiO2 – кварц, Al2O3 – корунд.
Таблиця 9. Загальна формула оксидів
| Валентність елемента | I | II | III | IV | V | VI |
| Загальна формула оксида | R2O | RO | R2O3 | RO2 | R2O5 | RO3 |
| Приклад | K2O | CaO | Al2O3 | CO2 | P2O5 | SO3 |
де R – умовно символ елемента.
Окиснення
Взаємодія речовин з киснем належить до реакцій окиснення.
Багато речовин реагують з киснем (окиснюються) при звичайній температурі. Якщо процес окиснення відбувається повільно, то теплота реакції виділяється поступово і розсіюється у довкілля. Прикладом повільного окиснення може бути утворення захисної оксидної плівки на поверхні алюмінієвих тіл, іржавіння заліза, потемніння металевих виробів, гниття, накопичення вуглекислого газу у кам’яновугільних шахтах внаслідок окиснення вугілля, тління сирого дерева, окиснення харчових продуктів. Під впливом кисню повітря, наприклад, окиснюється гній, тому в парниках і теплицях його використовують як біологічне паливо для підігрівання ґрунту і повітря. Реакції повільного окиснення безперервно відбуваються в живих організмах.
Горіння
Реакція окиснення, у якій сполучення з киснем відбувається швидко й супроводжується виділенням світла і тепла, називається горінням.
Ви вже знайомі з процесами горіння речовини у кисні. Горіння в повітрі відбувається повільніше, ніж у кисні, оскільки в повітрі кисень розбавлений азотом, і з поверхнею речовини, що горить, стикається менше молекул кисню. Температура горіння речовин в кисні більш висока, ніж температура горіння на повітрі, оскільки частина теплоти витрачається на нагрівання складових повітря.
Таблиця 10. Горіння і повільне окиснення
| Ознаки процесу | Приклади | |
| Швидке окиснення або горіння | Виділяється теплота і світло | Горіння дров, вугілля, газу |
| Повільне окиснення | Виділяється теплота | Потемніння металевих виробів, розкладання гною, повільне окиснення вугілля в шахтах |
Коли недостатньо відводиться теплота, яка виділяється під час повільного окиснення якогось матеріалу, його температура може підвищуватися до температури займання. Тоді повільне окиснення переходить у горіння, відбувається самозаймання. На заводах і автобазах забороняється скидати в купи просочені автомобільним маслом ганчір’я, щоб не трапилося самозаймання.
У багатьох випадках реакції горіння речовин у кисні починаються лише після запалювання і супроводжуються виділенням великої кількості теплоти й утворення полум’я. Процеси горіння використовують у щоденному житті і техніці для отримання тепла чи світла.
Умови виникнення і припинення горіння
Для виникнення горіння необхідно:

Рис. 73. Вогняний трикутник
1. Паливо
Без палива вогонь гасне. Пожежники послуговуються цим принципом при гасінні пожеж у зонах лісів та чагарників, створюючи на шляху полум’я протипожежну смугу або просіку. А вдома, на кухні, щоб припинити доступ до палива, іноді треба лише вимкнути газ.
2. Кисень
Вогонь, подібно до нас, повинен дихати. Киньте на нього лопату землі або покривало, і він «задихнеться». Якщо рівень кисню зменшити до 15% у порівнянні із тим, який є у повітрі (21%), то багато займистих речовин перестануть горіти.
3. Жар
Джерелом загоряння у побуті може бути обігрівач, кухонна плита, перевантажена електропроводка, іскра; у природі – блискавка, леткі речовини, тепло від гниючих рослин.
Щоб запалити речовину в повітрі, її спочатку потрібно нагріти до певної температури – температури займання. Температура займання дерева і сірки близько 270ºС, вугілля – 350ºС. Якщо повітря має доступ до речовини, що зайнялася, то вона продовжує горіти, бо теплота, яка виділяється під час горіння, підігріває речовину до температури її займання і вищої.
Для припинення горіння треба або охолодити речовину до температури, нижчої від температури займання, або припинити доступ до неї кисню.
Таблиця 11. Умови виникнення і припинення горіння
| Умови виникнення горіння | Умови припинення горіння |
| 1. Нагрівання речовини до температури займання | Різке пониження температури |
| 2. Забезпечення доступу повітря або кисня | Припинення доступу повітря або кисня |
Для гасіння пожежі використовують воду, вогнегасники, брезент, пісок. Під час випаровування вода знижує температуру речовини і зменшує доступ до неї кисню. Під час роботи вогнегасника виділяється вуглекислий газ, який змішується зі спеціальною рідиною, утворюючи піну. Піна перешкоджає доступу кисню й горіння припиняється.
Підсумок
- Хімічні реакції кисню з речовинами відносять до реакцій окиснення, а утворені речовини – до оксидів.
- Оксиди – це складні речовини, утворені двома елементами, один з яких – Оксиген.
- У результаті реакцій горіння виділяється тепло і світло.
Взаємодія кисню зі складними речовинами(повне окиснення металу). Умови виникнення та припинення горіння.
Горіння за сучасними уявленнями — складний фізико-хімічний процес на основі екзотермічних реакцій окиснення-відновлення, який характеризується значною швидкістю перебігу, виділенням великої кількості тепла і світла, масообміном з навколишнім середовищем. Під час горіння, як правило, утворюється полум'я. Горіння може початися зненацька внаслідок самозаймання або бути ініційоване запалюванням. Стосовно до вибухових речовин розрізняють стаціонарне або нормальне горіння (постійна швидкість розповсюдження від часток см/с до сотень см/с) та нестаціонарне або вибухове (нестабільна швидкість до сотень м/с).Горіння виникає, коли є горюча речовина, окислювач та джерело запалювання. Окислювачами можуть бути кисень, повітря, бертолетова сіль, пероксид натрію, азотна кислота, хлор, флуор, бром, оксиди азоту тощо. Горіння може бути повним і неповним. Повне — за достатньої або надлишкової кількості окислювача і за такого горіння виділяються нетоксичні речовини. Неповне — відбувається за недостатньої кількості окислювача. За неповного горіння утворюються продукти неповного згорання, серед яких є токсичні речовини (чадний газ, водень).
За швидкістю руху суміші горіння поділяється на повільне горіння (або дефлаграцію) і детонаційне горіння (детонацію). Хвиля дефлаграційного горіння поширюється з дозвуковою швидкістю[ru], а нагрівання вихідної суміші здійснюється в основному теплопровідністю. Детонаційна хвиля рухається з надзвуковою швидкістю, при цьому хімічна реакція підтримується завдяки нагріванню реагентів ударною хвилею і, в свою чергу, підтримує стійке поширення ударної хвилі[15][16]. Повільне горіння поділяється на ламінарне і турбулентне в залежності від характеру плину суміші[17]. В детонаційному горінні плин продуктів завжди турбулентний. За певних умов повільне горіння може переходити в детонацію[18] (англ. DDT, deflagration-to-detonation transition[19]).
Якщо вихідні компоненти суміші — гази, то горіння називають газофазним (або гомогенним). В газофазному горінні окиснювач (зазвичай, кисень) взаємодіє з пальним (наприклад, воднем чи природним газом). Якщо окиснювач і пальне заздалегідь перемішані на молекулярному рівні, то такий режим називається горінням попередньо перемішаної суміші (англ. premixed combustion). Якщо ж окиснювач і пальне відділені один від одного у вихідній суміші і надходять в зону горіння з допомогою дифузії, то горіння називається дифузійним[20].
Якщо спочатку окиснювач і пальне перебувають в різних фазах, то горіння називається гетерогенним. Зазвичай, у цьому випадку реакція окиснення також іде в газовій фазі в дифузійному режимі, а тепло, що виділяється в реакції, частково витрачається на термічний розклад і випаровування пального[21]. Наприклад, за цим механізмом горять вугілля чи полімери у повітрі. В деяких сумішах можуть відбуватися екзотермічні реакції в конденсованій фазі з утворенням твердих продуктів без суттєвого газовиділення. Такий механізм називається твердофазним горінням.
Виділяють також такі особливі види горіння, як тління, безполум'яне і холоднополум'яне горіння.
Горінням, або ядерним горінням, називають термоядерні реакції в зорях, у яких в процесах зоряного нуклеосинтезу утворюються ядра хімічних елементів[22].
Полум'я
Полум'я — це світна зона, утворена в ході горіння. Температура полум'я залежить від складу вихідної суміші й умов, за яких здійснюється горіння. При горінні природного газу в повітрі температура в гарячій зоні може перевищувати 2000 К, а при горінні ацетилену в кисні (газове зварювання) — 3000 К[23].
Колір полум'я
В зоні горіння можуть виникати вільні радикали й молекули в електронно-збуджених і коливально-збуджених станах. Якщо інтенсивність свічення достатньо висока, то його можна побачити неозброєним оком. Колір полум'я визначається тим, на яких частотах ідуть квантові переходи, що роблять основний внесок у випромінювання в видимій області спектра. Значна частина випромінювання, особливо при наявності твердої фази, пилинок або частинок сажі в полум'ї, припадає на інфрачервону область, яка суб'єктивно сприймається як жар від вогню. В інфрачервоне випромінювання роблять внесок коливально-збуджені молекули CO, CO2 і H2O.
При горінні водню в чистому повітрі полум'я майже безбарвне. Воно має ледь помітний блакитний відтінок через випромінювання радикалів OH в оптичному діапазоні на довжинах хвиль 306—308 нм[24]. Однак зазвичай водневе полум'я в повітрі світиться сильніше через наявність пилинок і органічних мікродомішок.
Полум'я при горінні вуглеводневих палив у пальнику Бунзена, таких як пропан чи бутан, може мати різний колір залежно від співвідношення пального і повітря. При горінні в дифузійному режимі без подачі повітря в пальник полум'я забарвлене в жовтий або червонуватий колір, викликаний свіченням розжарених мікрочастинок сажі. При підмішуванні невеликої кількості повітря на виході з пальника виникає неяскравий синій конус полум'я. Подальше збільшення подачі повітря призводить до виникнення двох конусів полум'я, внутрішнього яскравого синьо-зеленого і зовнішнього синьо-фіолетового, набагато менш інтенсивного[25].
Здатність домішок забарвлювати полум'я в різні кольори використовується в аналітичній хімії для пірохімічного аналізу і в піротехніці для салютів, феєрверків та сигнальних ракет.
Таблиця – Основні характеристики реакцій горіння і межі займання деяких газів
| Газ | Формули реакцій з киснем | Теплота згоряння, МДж/м3 | Витрата повітря для спалювання, м3/м3 | Температура займання, °С | |
| Вища | Нижча | ||||
| Водень Оксид вуглецю Метан Етан Пропан Бутан Пентан Етилен Пропілен Бутилен Пентилен Ацетилен | Н2+0,5О2=Н2О 2СО+О2=2СО2 СН4+2О2=СО2+2Н2О 2С2Н6+7О2=4СО2+6Н2О С3Н8+5О2=3СО2+4Н2О С4Н10+6,5О2=4СО2+5Н2О С5Н12+8О2=5СО2+6Н2О С2Н4+3О2=2СО2+2Н2О С3Н6+4,5О2=3СО2+3Н2О С4Н8+6,0О2=4СО2+4Н2О С5Н10+7,5О2=5СО2+5Н2О С2Н2+2,5О2=2СО2+Н2О | 12,8 12,6 38,82 70,3 101,2 133,8 169,3 63,0 91,7 121,4 150,7 58,0 | 11,7 12,0 35,9 64,4 93,2 123,6 156,6 59,1 86,0 113,5 140,9 58,0 | 2,38 2,38 9,52 16,66 23,80 30,94 38,08 14,28 21,42 28,56 35,70 11,90 | 410 610 545 530 504 430 284 510 455 440 298 335 |
Той, хто біжить по колу, через певний час повертається на те місце, звідки починав бігти. Колообіг Оксигену можна уявити як біг по колу кількох спортсменів, тобто як естафету. Розпочинав її кисень, що входить до складу повітря. Він потрапляє у тіла живих істот і бере участь у диханні. У живих клітинах естафету підхоплюють органічні речовини. Вони разом з киснем стають учасниками повільного окиснення. Цей процес завершується вивільненням енергії, утворенням вуглекислого газу та води. Вуглекислий газ і вода — продовжувачі бігу Оксигену по колу. Вони надходять у повітря, і рослини та зелені водорості утворюють з них на сонячному світлі органічну речовину — глюкозу. Одночасно з цим у повітря виділяється кисень. Естафета добігає кінця, коло замикається. Причому нові порції кисню та органічних речовин готові до повторення колообігу. Цей складний процес відбувається в природі постійно. До нього долучаються машини, заводи тощо. Вони поглинають кисень у великих кількостях, а в довкілля надходить Оксиген у вигляді вуглекислого газу, води.
До колообігу Оксигену причетні не лише живі істоти, але й відмерлі рештки рослинних і тваринних організмів. У великій кількості кисень витрачається на їх гниття. Внаслідок цього ґрунт збагачується гумусом, яким живляться рослини, а отже, Оксиген обов’язково потрапляє до складу органічних речовин їжі рослиноїдних тварин і людини.
Відновіть у пам'яті
3 чого складається ґрунт та що називають гумусом?
Колообіг хімічного елемента Оксигену в природі полягає у переміщенні його атомів між тілами живої і неживої природи. Завдяки колообігу Оксигену у живій природі підтримується вміст кисню в повітрі.
Наочно колообіг Оксигену ілюструє малюнок 92.

Мал. 92. Колообіг Оксигену в природі
* Естафета — вид спортивних змагань, в яких учасники передають один одному чергу при виконанні частин групового завдання.
Доки відбуватиметься фотосинтез, колообіг Оксигену не припиниться. Зелені рослини будуть продукувати кисень та оксигеновмісні органічні речовини, а інші істоти їх споживатимуть.
ОЗОНО3. Розглядаючи колообіг Оксигену, не можна обійти увагою озон — просту речовину з трьохатомною молекулою. Озон утворюється з кисню під впливом сонячних променів. У нижніх шарах атмосфери його дуже мало — приблизно 1 мг/м3. З віддаленням від поверхні Землі вміст озону зростає. На висоті 20-25 км він утворює озоновий шар — надійний захисток нашої планети від шкідливого випромінювання Сонця та від рижого її охолодження. Без озонового шару середня температура на Землі була б на 30 °С нижча.
Озон забезпечує збереження життя на Землі. Він перешкоджає потраплянню на поверхню Землі згубних для живих істот компонентів сонячного випромінювання, захищає Землю від переохолодження.
Нині науковці стурбовані появою у ньому озонових «дір» і пов'язують їх утворення з надходженням у повітря великої кількості оксидів Нітрогену, розвитком реактивної авіації, а також масовим використанням органічних речовин фреонів. Без них досить довго не обходилися при виготовленні різних засобів побутової хімії та парфумерних виробів в аерозольних упаковках, наприклад, лак для волосся, освіжувачі повітря, дезодоранти тощо. Ці речовини безпечні у близьких до Землі шарах атмосфери, але на великих висотах вони виділяють руйнівний для озону хлор.
Особливістю озону є те, що він розкладається на кисень, але спершу з 1 молекули озону утворюється молекула кисню й атом Оксигену (атомарний кисень). Ці атоми мають сильну знезаражувальну дію. Тому на водоочисних станціях озоном все частіше очищають питну воду від мікроорганізмів.
ЗАСТОСУВАННЯ КИСНЮ. Застосування кисню обумовлено його здатністю підтримувати дихання й горіння. Зокрема енергія, що виділяється в результаті горіння палива (дров, вугілля, природного газу), використовується у вигляді теплоти для обігрівання приміщень, отримання високих температур у виробництві різних речовин і матеріалів. Кисень необхідний для добування металів, їх обробки та зварювання. За допомогою суміші кисню й органічної речовини ацетилену С2Н2 зварюють та ріжуть метали. Завдяки тому, що у зварювальних апаратах ацетилен згоряє в чистому кисні, а не повітрі, температура полум'я сягає 3000 °C. Це майже удвічі перевищує температуру плавлення заліза. Явище супроводжується сліпучим полум’ям, яке шкідливе для зору. Тому зварювальник працює у спеціальній масці, яка захищає очі та обличчя від сліпучого полум’я і бризок розплавленого металу. Увага! На місці виконання зварювальних робіт чи різання металу, не можна дивитися на полум’я, щоб не зашкодити своєму зору!
Додавання кисню до повітря дозволяє досягати вищих температур під час горіння, тому при виплавлянні чавуну й виробництві сталі повітря збагачують киснем. Відкриття та промислове впровадження продування кисню в печі з добування сталі належать українському вченому-металургу Миколі Ілларіоновичу Мозговому.
Кисень застосовують у промисловості для добування чавуну й сталі, рідкого палива, змащувальних матеріалів, кислот, добрив.
Рідкий кисень як окиснювач палива використовують в космонавтиці, авіації, на підводних човнах. Також ним просочують пористі легкозаймисті матеріали (наприклад, дерев’яні ошурки або сухий мох) і використовують в якості вибухівки при прокладанні тунелів, добуванні руд.
Кисень життєво необхідний для дихання. Коли людина потрапляє в умови недостатньої кількості кисню (наприклад альпіністи, аквалангісти, космонавти), вона використовує кисневі маски й балони. З лікувальною метою використовують кисневі подушки, апарати штучного дихання, кисневі коктейлі й ванни.
Деякі приклади застосування кисню представлено на малюнку 93.


Мал. 93. Застосування кисню: а — плавлення металів; 6 — газове різання металів; в — нагрівання приміщень; г — реактивні двигуни; д — апарати для дихання; е — контрольовані вибухи при розробці копалин; є — киснева камера
Завдяки високій хімічній активності кисень широко використовується в промисловості, медицині. За його участю добувають метали, виробляють добрива, створюють умови для нормального дихання людей у ситуаціях недостатньої кількості повітря.
Ферум. Залізо. Фізичні та хімічні властивості заліза: взаємодія з киснем, сіркою.
Залізо — метал помірної хімічної активності. Особливо чисте залізо доволі стійке в сухому повітрі. Проте одержати чисте залізо надто важко. Разом з тим відоме одне з чудес світу — стародавня колона з хімічно чистого заліза в Делі (Індія). Вона заввишки 7 м і масою 6 т. Дослідники колони не виявили на ній жодних впливів вологого й теплого клімату Індії, жодних слідів іржавіння, хоча встановлена вона, як свідчить напис на ній, у IX ст. до н. е. З тих пір минуло 2800 років, а іржі немає. Це залишається загадкою й сьогодні.
Залізо взаємодіє з багатьома неметалами: киснем, сіркою тощо.
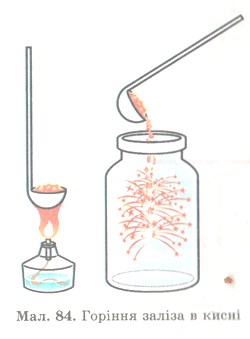
Дослід 1. Взаємодія з киснем
* Пригадай, як виконували цей дослід, коли вивчали кисень.
До скрученої в спіраль тонкої дротини прикріплюємо половину сірника, запалюємо його й опускаємо в банку, заповнену киснем, на дні якої насипано пісок. Трісочка яскраво розгоряється, зрештою займається й дротина. Залізо горить, розкидаючи в усі боки яскраві іскри — частинки залізної ожарини Fе3O4 (мал. 69). Вони падають на дно банки і частково осідають на її стінках у вигляді бурого нальоту.
* Склади рівняння реакції, яку спостерігаєш.
* Поясни, що спільного і чим відрізняється дослід на мал. 84.
Залізо взаємодіє з багатьома неметалами: киснем, сіркою тощо.
Дослід 1. Взаємодія з киснем
* Пригадай, як виконували цей дослід, коли вивчали кисень.
До скрученої в спіраль тонкої дротини прикріплюємо половину сірника, запалюємо його й опускаємо в банку, заповнену киснем, на дні якої насипано пісок. Трісочка яскраво розгоряється, зрештою займається й дротина. Залізо горить, розкидаючи в усі боки яскраві іскри — частинки залізної ожарини Fе3O4 (мал. 69). Вони падають на дно банки і частково осідають на її стінках у вигляді бурого нальоту.
* Склади рівняння реакції, яку спостерігаєш.
* Поясни, що спільного і чим відрізняється дослід на мал. 84.
Мал. 84. Горіння заліза в кисні.
На повітрі під впливом вологи і кисню залізо легко вкривається іржею, яка не захищає його від подальшого окиснення. Тому поступово залізо окиснюється по всій масі металу.
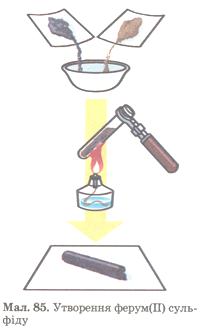
Дослід 2. Взаємодія з сіркою
У порцеляновій ступці змішуємо порошок сірки масою 2 г і порошок заліза масою 3,5 г. Суміш всипаємо в пробірку і добре нагріваємо її трохи вище дна. Коли стане помітним, що маса починає розжарюватися, припиняємо нагрівання пробірки. Реакція сполучення заліза і сірки далі енергійно перебігатиме сама (чому?):
Fе + S = FеS
Утворився ферум(ІІ) сульфід. Після охолодження розбиваємо пробірку, аби дістати продукт реакції (мал. 85).
На повітрі під впливом вологи і кисню залізо легко вкривається іржею, яка не захищає його від подальшого окиснення. Тому поступово залізо окиснюється по всій масі металу.
Дослід 2. Взаємодія з сіркою
У порцеляновій ступці змішуємо порошок сірки масою 2 г і порошок заліза масою 3,5 г. Суміш всипаємо в пробірку і добре нагріваємо її трохи вище дна. Коли стане помітним, що маса починає розжарюватися, припиняємо нагрівання пробірки. Реакція сполучення заліза і сірки далі енергійно перебігатиме сама (чому?):
Fе + S = FеS
Утворився ферум(ІІ) сульфід. Після охолодження розбиваємо пробірку, аби дістати продукт реакції (мал. 85).
Мал. 85. Утворення ферум (II) сульфіду.
КОРОТКІ ВИСНОВКИ
Елемент Ферум має велике значення у життєдіяльності живих організмів, оскільки є кровотворним елементом, входить до складу гемоглобіну крові.
Елемент Ферум утворює просту речовину — залізо. Хімічно чисте залізо має унікальні властивості — не іржавіє і намагнічується в магнітному полі. Воно являє собою сріблясто-білий м'який метал із характерним блиском, тугоплавкий, важкий. Залізо взаємодіє з киснем, сіркою та іншими неметалами, проявляючи при цьому валентність 2 і 3.
Завдання для самоконтролю
1. Опиши біологічну роль хімічного елемента Феруму.
2. Схарактеризуй фізичні властивості заліза.
3. Поясни хімічні властивості заліза, які тобі відомі, й склади рівняння відповідних реакцій.
4. Порівняй оксиди Феруму Fе2O3 і FеO за складом і вмістом Феруму. В якому з них масова частка Феруму більша?
КОРОТКІ ВИСНОВКИ
Елемент Ферум має велике значення у життєдіяльності живих організмів, оскільки є кровотворним елементом, входить до складу гемоглобіну крові.
Елемент Ферум утворює просту речовину — залізо. Хімічно чисте залізо має унікальні властивості — не іржавіє і намагнічується в магнітному полі. Воно являє собою сріблясто-білий м'який метал із характерним блиском, тугоплавкий, важкий. Залізо взаємодіє з киснем, сіркою та іншими неметалами, проявляючи при цьому валентність 2 і 3.
Завдання для самоконтролю
1. Опиши біологічну роль хімічного елемента Феруму.
2. Схарактеризуй фізичні властивості заліза.
3. Поясни хімічні властивості заліза, які тобі відомі, й склади рівняння відповідних реакцій.
4. Порівняй оксиди Феруму Fе2O3 і FеO за складом і вмістом Феруму. В якому з них масова частка Феруму більша?
За поширенням у природі Ферум посідає четверте місце серед елементів. Зустрічається виключно у сполуках. У земній корі його міститься 4,65%. Це дуже багато, але людям доступна мала його кількість: більша частина перебуває в розсіяному стані. Основні мінерали, що містить Ферум – це залізняки:
- червоний залізняк (гематит) – Fe2O3;
- магнітний залізняк (магнетит) – Fe3O4;
- шпатовий залізняк (сидерит) – FeCO3;
- бурий залізняк (лимоніт) – Fe2O3 ∙ H2O;
- пірит – FeS2.
Найбагатшими родовищами гематиту на Україні є Криворізький залізорудний басейн; лимоніту – Керченське родовище. У воді багатьох мінеральних джерел містяться солі Феруму, наприклад гідрогенкарбонат Fe(HCO3)2. В організмі дорослих людей всього біля 3,5 г Феруму. Основна його маса входить до складу еритроцитів (75%). Багато Феруму в печінці, селезінці та кістковому мозку. Чимало його в цитоплазмі, де за його участю відбувається процес внутріклітинного дихання.
Зрідка зустрічається самородне залізо космічного (метеоритного) походження: залізо входить до складу метеоритів.
Застосування заліза
Застосування заліза в людській цивілізації поклало початок залізному віку. Бронза давала засоби праці і зброю, але не могла замінити кам’яне знаряддя. Це зробило залізо. З усіх металів залізо має найбільше значення у житті людини. Уся сучасна техніка пов’язана із застосуванням заліза та його сплавів. Це пояснюється здатністю його значно поліпшувати фізико-хімічні властивості під впливом різних компонентів.
Залізо здатне швидко намагнічуватися й розмагнічуватися, тому його застосовують для виготовлення осердя електромагнітів, електромашин, трансформаторів. Його використовують для виготовлення мембран мікрофонів, як каталізатор при синтезі амоніаку та деяких органічних сполук.
Найбільше на практиці використовують сплави заліза – чавун і сталь. Сплави заліза є основою машинобудування.
Із чавуну виготовляють масивні деталі машин, грати мостів, труби, хімічну апаратуру, різні художні вироби. З нього зроблено всесвітньо відому огорожу літнього саду в Петербурзі. Чавун із домішками магнію стає дуже міцним і не крихким. З такого чавуну виготовляють колінчасті вали суднових двигунів.

Використання чавуну
Із сталі виготовляють вимірювальні і ріжучі інструменти, кузови автомобілів, побутові холодильники, пральні машини, дахове залізо, консервні банки. Сталі з особливими властивостями (нержавіючі, жаростійкі, магнітні) використовують для виготовлення деталей газових турбін, реактивних двигунів, ракетних установок, обладнання у хімічній, харчовій та інших галузях промисловості. У побут нержавіюча сталь увійшла у вигляді ножів, ложок, виделок та різних предметів загального вжитку. Вироби із сталі прикрашають арки станцій метрополітену. Сполуки заліза використовують в медицині для лікування анемій (недостатня кількість червонокрівців).

Використання сталі
Руйнування заліза в природних умовах
Усім відомо, що залізні вироби під дією повітря, дощу, вологи іржавіють, тобто залізо покривається жовто-бурою іржею і переходить у стан таких хімічних сполук, які містяться в рудах. Чисте, метеоритне залізо не підлягає корозії. Але залізо, яке добувають на Землі містить домішки інших елементів. Корозійне руйнування заліза та його сплавів зумовлене перебігом таких реакцій:
а) в атмосфері кисню: 4Fe + 3O2 → 2Fe2O3;
б) у вологому повітрі: 2Fe + 2H2O + O2 = 2Fe(OH)2 або
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3.
б) у вологому повітрі: 2Fe + 2H2O + O2 = 2Fe(OH)2 або
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3.
Процес руйнування металів називається корозією (з латинської korrodere – «роз’їдати»).

Корозія металів
Іржа легко відшаровується, вона пухка, проникна для кисню і вологи. Тому шар іржі не захищає залізо від подальшого руйнування. У результаті корозії поступово руйнуються металеві конструкції, деталі машин, стають непридатними інструменти.
Особливо сильної корозії зазнають металеві матеріали в апаратах хімічної промисловості від дії кислот, лугів та інших агресивних речовин, до того ж, як правило, за високих температур і підвищеного тиску. Пряма втрата заліза від корозії складає понад 10% щорічної виплавки металу, це – понад 20 млн. тонн заліза в світі. Вчені вважають, що кожна шоста домна працює на повернення збитків від корозії.
Проте шкода від корозії не зводиться лише до втрати металу через його руйнування. Величезні витрати пов’язані з:
- виведенням із ладу деталей, обладнання і цілих механізмів;
- витратами на ремонт пошкоджених деталей машин та обладнання або їх заміну;
- втрата нафти та газу з пошкоджених трубопроводів;
- втрата здоров’я і життя під час аварій, пов’язаних із пошкодженням деталей машин;
- витратами на захист від корозії.
Підсумок
- Ферум належить до числа найбільш поширених елементів у природі (четверте місце).
- У Землі Ферум зустрічається виключно у сполуках.
- Залізо і його сплави є основою машинобудування.
- Корозія – це руйнування металів і сплавів під дією умов оточуючого середовища.
?
- У якому вигляді зустрічається Ферум у природі?
- До складу яких залізняків входить Ферум?
- Наведіть приклади застосування заліза.
- Що таке корозія металів?
- Які наслідки процесу ржавіння заліза.
- Назвіть компоненти довкілля, що спричиняють корозію металів?
Цифри і факти
• Величезну масу заліза витрачено на всі війни земної кулі. Лише у першу світову війну було витрачено 200 млн. тонн сталі, за другу світову війну – близько 800 млн. тон. За останні три роки другої світової війни було виготовлено 660 тис гармат, більше 1 млн. кулеметів, біля 6 млн. автоматів. Із сплавів заліза виготовляють танки, бронеавтомобілі, артилерійські установки, бронепоїзди та інше.
• Російська назва заліза («железо») походить від слова «жель», що означає «блищати». «палати». Поширеність і відносна простота добування із руд зробили залізо доступним ще у давнину – залізний вік прийшов на зміну бронзовому у другому тисячолітті до нашої ери.
• У 1910 році в Стокгольмі, на міжнародному геологічному конгресі радянський вчений А. Е. Ферсман «намалював картину», яка могла відбутися на Землі, якби наступив «залізний голод». «На вулицях жах руйнування: ні вагонів, ні потягів, ні автомобілів; навіть камінь перетворився б у глиняну масу, рослини загинули б. Руйнівна буря пронеслася б над землею і смерть людства стала б неминуча, хоча людина не дожила б до цього часу, втративши три грами Феруму зі свого тіла». За прогнозами вченого, він мав наступити до 1970 року.
• Перше залізо, яке потрпило до рук людини було не земного, а космічного походження – метеоритне, тому його назвали «небесним каменем». Щорічно на Землю випадали тисячі тон метеоритної речовини, деякі зі вмістом 90 відсотків Феруму.
• Найбільший метеорит знайдено 1920 року в Африці, який важив 60 тон. У 1895 році у льодах Гренландії знайшли метеорит масою 34 тони. У кінці минулого століття в аризонській пустелі знайдена вибоїна розміром 1200х175 метрів – слід гігантського метеорита.
• У давнину залізо цінувалося більше за золото. У Сародавньому Римі з нього виготовляли шлюбні обручки. У гробницях фараонів знайдено залізні шоломи, зброя.
• Залізо – метал-трудівник. Уже на початку ХІХ століття із кожних 100 кг металу, який використовували у промисловості і сільському господарстві – 95% припадає на залізо. Однак залізною зброєю руйнується все те, що людина створювала із заліза і за його допомогою.
• У 1778 році побудовано перший залізний міст, 1778 – перший залізний водопровід, 1818 – перший залізний корабель.
• Добувати чисте залізо на Землі ще не навчилися, тому воно й іржавіє. В Індії є колонна із чистого заліза, ймовірно метеоритного походження, висотою 7 метрів, вагою 6,5 тон, даіметром 30-42 см, яка не іржавіє.
Домашній експеримент
Очистка від іржі
 Листки й стебла картоплі або помідор подрібніть ножем і залийте слабким розчином хлоридної кислоти (5%). Аптечну кислоту розводять водою навпіл. Посудину із сумішшю закрийте і дайте настоятися. Через 5-7 днів злийте екстракт і приготуйте травильний розчин. Якщо іржі багато, то на 5 об’ємів екстракту добавте 40 об’ємів хлоридної кислоти і 30 об’ємів води. Якщо іржі небагато то на 5 об’ємів екстракту добавте 10 об’ємів кислоти. Можна добавити невелику кількість води. У травильний розчин опустіть іржаву деталь. Вона швидко стане як нова, а метал при цьому не зруйнується.
Листки й стебла картоплі або помідор подрібніть ножем і залийте слабким розчином хлоридної кислоти (5%). Аптечну кислоту розводять водою навпіл. Посудину із сумішшю закрийте і дайте настоятися. Через 5-7 днів злийте екстракт і приготуйте травильний розчин. Якщо іржі багато, то на 5 об’ємів екстракту добавте 40 об’ємів хлоридної кислоти і 30 об’ємів води. Якщо іржі небагато то на 5 об’ємів екстракту добавте 10 об’ємів кислоти. Можна добавити невелику кількість води. У травильний розчин опустіть іржаву деталь. Вона швидко стане як нова, а метал при цьому не зруйнується.


Комментариев нет:
Отправить комментарий