Фізичні властивості середніх солей
Солі — це складні речовини, що містять катіони металічних елементів та аніони кислотних залишків.
У формулах солей на першому місці пишуть символ металічного елемента, а потім кислотний залишок:

Таблиця 5
Кислотні залишки
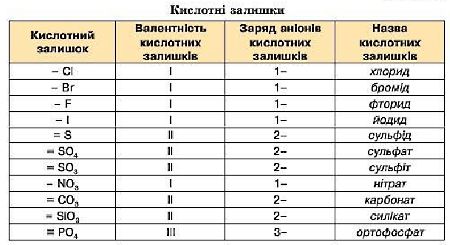
Назви солей складаються:
• для елементів зі сталою валентністю:

• для елементів зі змінною валентністю:

наприклад: FeSO4 — ферум (ІІ) сульфат, CuCl2 — купрум (ІІ) хлорид.
наприклад: K2SO3 — калій сульфіт, CaCO3 — кальцій карбонат;
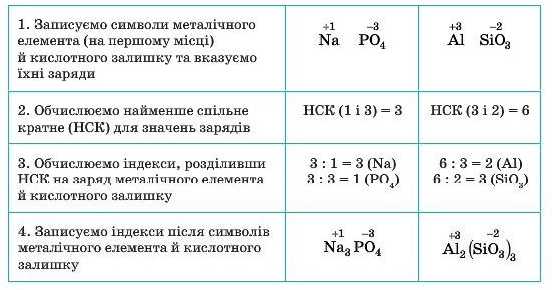
Формули солей складають аналогічно формулам оксидів, зрівнюючи заряди атомів металічного елемента й кислотного залишку.
Алгоритм складання формул солей
(на прикладі натрій ортофосфату та алюміній силікату)
Виконай інтерактивну вправу: Назвати солі за їх хімічними формулами
Деякі солі, що широко використовуються в побуті, крім наукових, мають побутові (традиційні) назви. Наприклад, ви вже знаєте, що натрій хлорид NaCl називають кухонною або кам’яною сіллю, натрій карбонат Na2CO3 — це кальцинована сода, калій карбонат K2CO3 — поташ. Традиційні назви найбільш уживаних солей наведено в опорній схемі.
Поширення солей у природі
У природі солі є основною складовою більшості мінералів. Кухонна сіль — галіт; кальцій карбонат — мармур, вапняк, крейда; кальцій сульфат CaSO4 — гіпс та інші.
Солі відіграють важливу роль у процесах обміну речовин у живих організмах. Вони обов’язково присутні в м’язах, кістковій та нервовій тканинах. Наприклад, солі Калію відповідають за роботу серцевого м’яза. Натрію — за передавання нервового сигналу, завдяки чому організм сприймає інформацію ззовні та реагує на неї. Для росту кісток і зубів необхідні солі Кальцію.
Солі розчинені у клітинному сокові рослин. Недостатня кількість солей у ґрунтах знижує врожайність культур, тому сільське господарство використовує певні солі як мінеральні добрива.
Фізичні властивості солей
Солі — йонні сполуки. За звичайних умов це тверді речовини, з високими температурами плавлення та кипіння. Солі переважно безбарвні, або, як кажуть, білі. Це, наприклад, хлориди та сульфати Калію, Натрію,
Магнію, Цинку й інші. Деякі можуть бути забарвлені в різні кольори та відтінки: купрум(ІІ) сульфід CuS — чорний; нікель(ІІ) сульфат NiSO4 — зелений; кобальт(ІІ) сульфат CoSO4 — рожевий.
Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
Загальні способи добування оксидів, кислот, основ і середніх солей
Добування оксидів здійснюють у різні способи. Ви вже знаєте з курсу хімії 7 класу, що оксиди є продуктами взаємодії простих і складних речовин з киснем (рис. 33.1). Винятки - золото, платина, інертні гази тощо. Ці речовини з киснем не реагують.

Рис. 33.1.1 - горіння магнію Mg + О2 → MgO; 2 - горіння фосфору Р + О2 → Р2О5; 3 - горіння сірки S + О2 → SO2; 4 - горіння метану СН4 + О2 → СО2 + Н2О.
Завдання. Перетворіть ці і наведені далі схеми реакцій на хімічні рівняння
Оксиди утворюються й унаслідок розкладання деяких оксигеновмісних речовин за нагрівання. Наприклад, випалюванням вапняку (кальцій карбонату) добувають негашене вапно (кальцій оксид) і вуглекислий газ (карбон(ІV) оксид):
Поміж продуктів реакцій розкладу нерозчинних основ, деяких солей та оксигеновмісних кислот є оксиди:


Рис. 33.2. Хімічний вулкан. Хром(ІІІ) оксид (1) - один з продуктів розкладання амоній дихромату (2)
Унаслідок нагрівання солей з кислотними та амфотерними оксидами також можуть утворюватися оксиди. Можливість перебігу реакції в цьому випадку залежить від відносної леткості оксидів - менш леткий оксид витісняє більш леткий оксид із солі:


Рис. 33.3. Під час виробництва скла відбувається низка хімічних реакцій. Одна з них - взаємодія натрій карбонату (соди) із силіцій(ІV) оксидом (кварцовим піском)
Поміж продуктів взаємодії солей слабких нестійких кислот із сильними кислотами є оксиди:

Рис. 33.4. Унаслідок дії хлоридної кислоти на натрій карбонат виділяється карбон(ІV) оксид
Дією водовідбирних речовин на кислоти або солі можна добути оксиди:
HNO3 + Р2О5 → (НРО3)4 + N2O5;
KMnO4 + H2SO4(конц.) → K2SO4 + Мn2О7 + Н2О;
КСlО4 + H2SO4(конц.) → K2SO4 + Сl2О7 + Н2О.
Добування кислот. Вам уже відомо, що взаємодією кислотних оксидів з водою добувають оксигеновмісні кислоти:
SO2 + Н2О → H2SO3;
Р2О5 + Н2О → Н3РО4.
Безоксигенові кислоти утворюються під час розчинення у воді продуктів реакції водню з деякими неметалами. Саме так у промисловості виробляють хлоридну кислоту:
Н2 + Сl2 → НСl.
Продукт реакції водню із сіркою - гідроген сульфід (сірководень) - складник не лише лікувальних мінеральних, а й стічних вод. Однак у довкіллі він утворюється в інший спосіб, ніж той, що описує рівняння реакції:
Н2 + S → H2S.
Ви вже знаєте, за яких умов (назвіть їх) можливі реакції обміну між сіллю й кислотою. Тому в лабораторії сірководень добувають дією розбавлених сильних кислот на сульфіди - солі слабкої сульфідної кислоти:
FeS + НСl → FeCl2 + H2S↑.
Цікаво і пізнавально
Уперше сірководень описав Карл Вільгельм Шеєле під назвою задушливого сірчаного газу. Шеєле отримав сірководень прямим синтезом і дією кислот на сульфіди Феруму(ІІ) і Мангану(ІІ).
Інші приклади добування кислот реакцією обміну описують схеми реакцій:

Добування основ. Луги добувають взаємодією оксидів активних металічних елементів з водою:
ВаО + Н2О → Ва(ОН)2.
Продуктами взаємодії відповідних металів (пригадайте, де вони розміщені в періодичній системі та ряді активності) з водою (рис. 33.5) також є луги:
K + H2O → KOH + H2
Са + Н2О → Са(ОН)2 + Н2

Рис. 33.5. Реакція калію з водою відбувається дуже активно
Спосіб добування нерозчинних основ реакціями обміну між лугом і сіллю в розчині вам також відомий:
MgSO4 + КОН → Mg(OH)2↓ + K2SO4
Са(ОН)2 + Na2CO3 → NaOH + СаСО3↓
Добування середніх солей ґрунтується переважно на взаємодії речовин із протилежними властивостями:
1) металу з неметалом:
Na + Сl2 → NaCl (рис. 33.6)
Zn + S → ZnS (рис. 33.7)

Рис. 33.6. 1. Реагенти - хлор і натрій, продукт реакції - натрій хлорид. 2. Реакція натрію з хлором

Рис. 33.7. Продукт взаємодії цинку із сіркою - цинк сульфід
2) металу з кислотою в розчині (пригадайте, як за положенням металу в ряді активності спрогнозувати можливість перебігу цих реакцій):
Zn + НСl → ZnCl2 + Н2↑
3) металу з розчином солі менш активного металу (пригадайте, як за положенням металу в ряді активності спрогнозувати можливість перебігу цих реакцій):
Fe + CuSO4 → FeSO4 + Cu
4) основного оксиду з кислотним оксидом:
MgO + СО2 → MgCO3
5) основного або амфотерного оксиду з кислотою:
6) лугу з кислотним або амфотерним оксидом:

7) основи з кислотою:
Са(ОН)2 + НСl → СаСl2 + Н2О
8) солі з кислотою:
MgCO3 + НСl → MgCl2 + Н2О + СО2↑
ВаСl2 + H2SO4 → BaSO4↓ + НСl
9) лугу із сіллю в розчині:
Ва(ОН)2 + Na2SO4 → NaOH + BaSO4↓
10) двох солей у розчині:
СаСl2 + К3РО4 → Са3(РО4)2↓ + КСl
Pb(NO3)2+ KI → KNO3 + PbI2↓
11) кислотного оксиду із сіллю:
ПРО ГОЛОВНЕ
• Загальні способи добування оксидів, кислот, основ, солей ґрунтуються на генетичних зв’язках між представниками різних класів неорганічних сполук. Окрім загальних існують і специфічні способи добування окремих представників класів неорганічних сполук.
Перевірте себе
Відтворіть за наведеними фрагментами схем реакцій хімічні рівняння:


Назвіть реагенти та продукти хімічних реакцій. Класифікуйте хімічні реакції.
Застосуйте свої знання й уміння
1. Проаналізуйте зміст уривка літературного твору. Визначте, про які речовини та хімічні реакції йдеться в ньому. Складіть хімічні рівняння: а) процесів, описаних в уривку; б) реакцій за участю речовин, згадуваних у ньому. Класифікуйте хімічні реакції, реагенти й продукти. «Шипить та куриться вапно, що його гасять у великих дощаних скринях». Іван Франко.
2*. Існували досить ефективні способи осушення дачного житла. Наприклад, на підлозі розкладали в плоскі тарілки невеликі шматки негашеного вапна. Убираючи вологу, вапно гаситься й розпадається на порошок. Якщо дача стояла в сирому місці, у низині, доводилося не тільки рятувати кімнати від вогкості, але й створювати гідроізолювальний шар навколо фундаменту. Довкруж будинку викопували рів завширшки 50-70 см, але досить глибокий, що сягав самої підошви фундаменту. Рів пошарово наповнювали негашеним вапном і рослинною золою, яка містила поташ - калій карбонат. Суть процесу полягала в тому, що негашене вапно, поглинувши вологу з ґрунту, підсушувало фундамент і стіни. Змішуючись із золою, перетворювалося на дуже щільний шар - різновид цементу, непроникний для ґрунтової вологи. За допомогою хімічних рівнянь поясніть цю технологію осушування.
3. Неперевершену художню цінність становлять авторські писанки. Найсучасніший метод писанкарства - так зване травлення, коли орнамент обробляється соляною кислотою і опускається нижче загального тла. Це нагадує вишивку білого на білому, адже барв тут здебільшого не застосовують. За допомогою хімічного рівняння поясніть цей метод.
4. Спосіб одержання штучної газованої води відкрито англійським хіміком Джозефом Прістлі. Після експериментів з газом, що виділяється під час шумування в чанах пивоварного заводу, він сконструював апарат, який дає змогу за допомогою насоса насичувати воду «вуглекислими» пухирцями. 1772 року Прістлі продемонстрував свій винахід Колегії фізиків у Лондоні. Назвіть продукт хімічної реакції, яка відбувається унаслідок насичення води вуглекислим газом. Класифікуйте цю хімічну реакцію.
5. Валерій розповів однокласникам, буцімто одного разу після рясного дощу квіти, які росли на лісовій галявині, змінили свій колір з фіолетового на червоний. Марійка сказала, що це вигадки, а Тарас - що така подія цілком імовірна. А як ви вважаєте? Оцініть вірогідність явища, описаного Валерієм.
6. Поясніть, як можна довести наявність лугу в розчинах, що утворилися внаслідок реакцій калію та кальцію з водою.
7. «Луги легко поглинають з повітря водяну пару, вуглекислий газ (карбон(ІV) оксид), сірчистий газ (сульфур(ІV) оксид), сірководень (гідроген сульфід). Якщо не вживати запобіжних заходів, луги міститимуть домішки солей». Проаналізуйте наведене застереження й висловіть припущення, яких саме запобіжних заходів потрібно вживати під час зберігання лугів та їхніх розчинів. Назвіть солі, які утворюватимуться внаслідок взаємодії лугів з газами, згадуваними у застереженні. Складіть відповідні хімічні рівняння й класифікуйте хімічні реакції.
8. Здавна в лісистих місцевостях Франції, Німеччини, Богемії виготовляли скло із застосуванням деревної золи та золи папороті, очерету й інших рослин. Ця зола багата на поташ (калій карбонат). У 1764 році професор Петербурзької академії К.Г. Лаксман під час варіння скла замінив поташ (калій карбонат) натрій сульфатом. Складіть рівняння реакцій, які відбуваються під час сплавляння золи та натрій сульфату з кварцовим піском (силіцій(ІV) оксидом). Класифікуйте ці хімічні реакції. Оцініть значення винаходу Лаксмана для збереження лісів.
9. Доберіть приклади хімічних рівнянь, які відповідають перетворенням, наведеним на рисунку 33.8. Назвіть реагенти та продукти хімічних реакцій. Класифікуйте хімічні реакції.

Генетичні зв'язки між основними класами неорганічних сполук
Тобі вже відомі деякі неорганічні речовини та ознаки їх поділу на окремі класи. Тепер треба передусім узагальнити знання про класифікацію речовин і перевірити уміння здійснювати її.
Поняття «класифікація» не є хімічним. Воно — загальнонаукове, оскільки рівною мірою належить усім наукам. Адже на ранніх етапах розвитку будь-якої науки спочатку збираються факти, далі їх класифікують, тобто об'єднують у групи за однією або кількома загальними ознаками і т. д.
основною ознакою є їх хімічний склад. Саме за складом усі неорганічні речовини поділяють на групи, класи, яким
характерні спільні хімічні властивості. Повторити й узагальнити свої знання про них тобі допоможе схема класифікації неорганічних речовин (мал. 6).
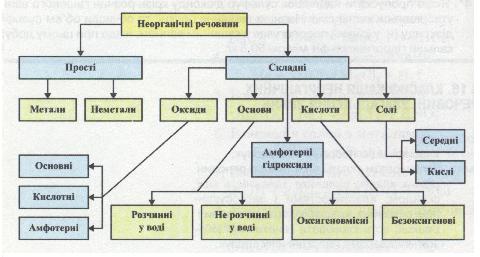
Мал. 6. Схема класифікації неорганічних речовин
Розглядаючи схему, постарайся відповісти на запитання й виконати завдання, наведені нижче. Якщо ти відчуєш труднощі або захочеш перевірити правильність своєї відповіді, звернися до тексту підручників 7-го і 8-го класів.
Поняття «класифікація» не є хімічним. Воно — загальнонаукове, оскільки рівною мірою належить усім наукам. Адже на ранніх етапах розвитку будь-якої науки спочатку збираються факти, далі їх класифікують, тобто об'єднують у групи за однією або кількома загальними ознаками і т. д.
основною ознакою є їх хімічний склад. Саме за складом усі неорганічні речовини поділяють на групи, класи, яким
характерні спільні хімічні властивості. Повторити й узагальнити свої знання про них тобі допоможе схема класифікації неорганічних речовин (мал. 6).

Мал. 6. Схема класифікації неорганічних речовин
Розглядаючи схему, постарайся відповісти на запитання й виконати завдання, наведені нижче. Якщо ти відчуєш труднощі або захочеш перевірити правильність своєї відповіді, звернися до тексту підручників 7-го і 8-го класів.
ЗАПИТАННЯ Й ЗАВДАННЯ
1. Які речовини називаються простими? На які дві групи вони поділяються? Наведи приклади.
2. Які речовини називаються складними?
3. На які класи поділяються складні неорганічні речовини? Наведи відповідні приклади.
4. Які речовини називаються оксидами? За якою ознакою і як їх класифікують?
Зверни увагу, коли розглядався клас оксидів, то вивчалася лише одна їх хімічна властивість — здатність оксидів неметалів взаємодіяти з водою, утворюючи кислоти, через що їх і називають кислотними оксидами, і здатність оксидів активних металів також взаємодіяти з водою, але утворювати при цьому луги (розчинні основи), через що їх називають основними оксидами. Під час вивчення хімічних властивостей інших класів сполук (кислот, основ, солей) траплялися реакції, що ілюструють інші хімічні властивості оксидів. Отже, тепер є нагода узагальнити знання про хімічні властивості оксидів (табл. 8).
Таблиця 8. Хімічні властивості оксидів

Зверни увагу на останнє рівняння реакції. Тут висвітлюється нова хімічна властивість оксидів — здатність реагувати між собою з утворенням солі, але за умови, що вони різні за складом, протилежні за властивостями: один — оксид металу (основний), інший — оксид неметалу (кислотний).
5. Що таке основа? Який склад цих речовин? Які властивості для них характерні?
6. Які речовини називають кислотами? Як їх класифікують? Які властивості для них характерні?
7. Які речовини належать до солей? З якими речовинами можуть взаємодіяти солі?
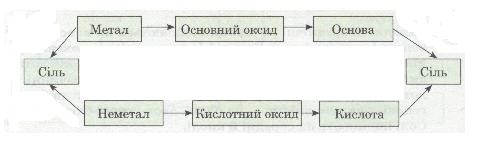
Ознайомлення з хімічними властивостями основних класів неорганічних сполук показує, що між ними існує взаємозв'язок, який можна подати такою схемою:
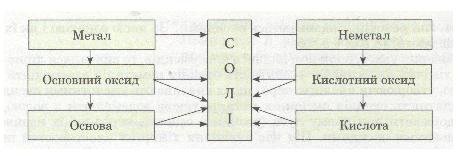
Мал. 7. Схема.
• Розглянь схему й подумай, які ще можливі шляхи одержання солей.
Із схеми видно, що існує два ряди речовин із протилежними властивостями (див. по вертикалі). Один ряд:
• Розглянь схему й подумай, які ще можливі шляхи одержання солей.
Із схеми видно, що існує два ряди речовин із протилежними властивостями (див. по вертикалі). Один ряд:
Метал → Основний оксид → Основа
характерний для елемента-металу. Другий ряд:
Неметал → Кислотний оксид → Кислота
характерний для елемента-неметалу.
Простежується генетичний зв'язок між речовинами всередині ряду і між рядами. У взаємодії речовин (див. по горизонталі) виявляється протилежність властивостей: метали реагують з неметалами; основні оксиди — з кислотними оксидами і кислотами; основи — з кислотами та кислотними оксидами.
Отже, речовини взаємозв'язані. З речовин одного класу за допомогою різноманітних хімічних реакцій можна добути речовини іншого класу.
Висновки
Складні неорганічні речовини поділяються на класи: оксиди, основи, кислоти і солі. Кожний із цих класів, у свою чергу, поділяється на групи. Так, оксиди бувають основні, кислотні та амфотерні. Основи — розчинні у воді (луги) і нерозчинні. Кислоти за складом класифікують на оксигеновмісні та безокси-генові, а за основністю — на одно-, двох-, три- і багатоосновні. Солі поділяють на середні й кислі.
Усі речовини між собою взаємозв'язані за походженням і за реакціями як між простими речовинами, так і між простими і складними речовинами, між складними речовинами — представниками різних класів, між речовинами взагалі.
Існує підпорядкованість речовин та їх перетворень загальним законам. Знання взаємозв'язків між речовинами потрібні людині для керування їх перетвореннями, для добування нових сполук, потрібних у промисловому виробництві, сільському господарстві, побуті тощо.
Завдання для самоконтролю
1. Із наведеного переліку формул речовин випиши окремо формули оксидів, кислот, основ, солей і зазнач їх назви: НСІ, H2SiO3, К2O, NaOH, Ва(ОН)2, К2СO3, HNO3, Fe(OH)3, H2S, SO2, H2SO4, Al2O3, Mg3(PO4)2, FeSO4.
2. Порівняй склад: а) оксидів і основ; б) оксидів і кислот; в) кислот і солей; г) основ і солей. Чим вони подібні і чим відмінні?
3. З якими речовинами, формули яких наведено, може взаємодіяти кальцій оксид: НСІ, NaOH, Н2O, СO2, H2SO4, MgO? Напиши рівняння можливих реакцій.
4. З якими речовинами, формули яких НСІ, Са(ОН)2, FeO, СO2, H2SO4, може реагувати натрій гідроксид? Напиши рівняння можливих реакцій.
5. У двох пробірках (без етикеток) містяться тверді речовини. Відомо, що це кальцій оксид і ферум(ІІІ) оксид. Як визначити, де яка речовина?
6. Склади чотири рівняння відомих тобі типів реакцій, в яких вода є або вихідним реагентом, або кінцевим продуктом.
7. Напиши рівняння реакцій, що показують зв'язок між речовинами різних класів, поданий у загальному вигляді такою схемою:
Отже, речовини взаємозв'язані. З речовин одного класу за допомогою різноманітних хімічних реакцій можна добути речовини іншого класу.
Висновки
Складні неорганічні речовини поділяються на класи: оксиди, основи, кислоти і солі. Кожний із цих класів, у свою чергу, поділяється на групи. Так, оксиди бувають основні, кислотні та амфотерні. Основи — розчинні у воді (луги) і нерозчинні. Кислоти за складом класифікують на оксигеновмісні та безокси-генові, а за основністю — на одно-, двох-, три- і багатоосновні. Солі поділяють на середні й кислі.
Усі речовини між собою взаємозв'язані за походженням і за реакціями як між простими речовинами, так і між простими і складними речовинами, між складними речовинами — представниками різних класів, між речовинами взагалі.
Існує підпорядкованість речовин та їх перетворень загальним законам. Знання взаємозв'язків між речовинами потрібні людині для керування їх перетвореннями, для добування нових сполук, потрібних у промисловому виробництві, сільському господарстві, побуті тощо.
Завдання для самоконтролю
1. Із наведеного переліку формул речовин випиши окремо формули оксидів, кислот, основ, солей і зазнач їх назви: НСІ, H2SiO3, К2O, NaOH, Ва(ОН)2, К2СO3, HNO3, Fe(OH)3, H2S, SO2, H2SO4, Al2O3, Mg3(PO4)2, FeSO4.
2. Порівняй склад: а) оксидів і основ; б) оксидів і кислот; в) кислот і солей; г) основ і солей. Чим вони подібні і чим відмінні?
3. З якими речовинами, формули яких наведено, може взаємодіяти кальцій оксид: НСІ, NaOH, Н2O, СO2, H2SO4, MgO? Напиши рівняння можливих реакцій.
4. З якими речовинами, формули яких НСІ, Са(ОН)2, FeO, СO2, H2SO4, може реагувати натрій гідроксид? Напиши рівняння можливих реакцій.
5. У двох пробірках (без етикеток) містяться тверді речовини. Відомо, що це кальцій оксид і ферум(ІІІ) оксид. Як визначити, де яка речовина?
6. Склади чотири рівняння відомих тобі типів реакцій, в яких вода є або вихідним реагентом, або кінцевим продуктом.
7. Напиши рівняння реакцій, що показують зв'язок між речовинами різних класів, поданий у загальному вигляді такою схемою:

Мал. 8. Схема.
Поширеність у природі та використання оксидів,кислот,основ і середніх солей. Вплив на довкілля.
Основним джерелом штучного забруднення атмосфери є промислові підприємства, транспортні засоби, підприємства комунального сектора, сільського господарства.
Серед галузей промисловості головними джерелами атмосферних забруднень виступають: електроенергетика (27%), металургія (26%), будівельна індустрія (13%). Підприємства теплоенергетики, металургійних і хімічних галузей, котельні установки споживають щороку близько 70% твердого і рідкого палива, яке видобувається. В результаті їх діяльності в атмосферу виділяються наступні газові викиди:
– вуглекислий газ (СО2) – продукти згорання палива, яких щорічно потрапляє в атмосферу понад 2 млрд. т. Нешкідливий для людського організму, використовується в побуті, господарських цілях. Особливу небезпеку створює вуглекислий газ, затримуючи теплове випромінювання в приземному шарі атмосфери. Оксид карбону — це сполука, що активно реагує зі складовими частинами атмосфери, він сприяє підвищенню температури на планеті й створенню парникового ефекту;
– чадний газ (СО) – продукт неповного згорання палива. В повітря потрапляє з автомобільними викидами (60%), викидами промислових підприємств, при спалюванні твердих відходів, при лісових пожежах. Щороку його поступає в атмосферу близько 250 млн. т. Значна частина його поглинається грунтовими мікроорганізмами. Газ без запаху, кольору, смаку. При значних концентраціях в закритих приміщеннях вступає в реакцію з гемоглобіном крові, витісняючи кисень і може призвести до кисневого голодування організму, його загибелі;
Оксиди нітрогену. Основними джерелами викиду є підприємства, що виробляють азотні добрива, азотну кислоту й нітрати, анілінові барвники, нітросполуки, віскозний шовк, целулоїд. Кількість оксидів нітрогену, що надходять в атмосферу, складає 20 млн т на рік.
Кислоти дуже небезпечні для здоров'я людини. При попаданні на шкіру викликають сильні опіки. Особливо небезпечне потрапляння в очі.
У випадку витоку або розливу соляна кислота може завдати істотної шкоди навколишньому середовищу. По-перше, це призводить до виділення пари речовини в атмосферне повітря в кількостях, які перевищують санітарно-гігієнічні нормативи, що може спричинити отруєння всього живого, а також появи кислотних опадів, які можуть призвести до зміни хімічних властивостей ґрунту і води.
По-друге, вона може просочитися в ґрунтові води, в результаті чого може відбутися забруднення внутрішніх вод. Там, де вода в річках і озерах стала досить кислою (рН менше 5) зникає риба. При порушенні трофічних ланцюгів скорочується число видів водних тварин, водоростей і бактерій.
У містах кислотні опади прискорюють процеси руйнування споруд з мармуру і бетону, пам'ятників і скульптур. При попаданні на метали кислоти викликають їх корозію.


Комментариев нет:
Отправить комментарий