Жири. Слади жирів, фізичні властивості. Жири у природі. Біологічна роль жирів.
Жири - природна сировина, з якої за допомогою хімічних перетворень уперше добули вищі карбонові кислоти (мал. 30.1) - насичені й ненасичені.
Перші припущення щодо наявності в жирах «прихованої кислоти» були зроблені ще в XVII столітті. Мила - натрієві й калієві солі вищих карбонових кислот - здавна виготовляли варінням жирів з лугом. 1741 р. французький хімік Клод Жозеф Жоффруа (1685-1752) дією сильної неорганічної кислоти на мило добув масну на дотик суміш. Він припустив, що добута маса є жиром. Досліджуючи її властивості, науковець виявив, що це не так.
Які ж були подальші кроки на шляху з'ясування хімічної природи хирів?
• Гідроліз жирів - хімічна реакція, за допомогою якої 1779 р. шведський хімік Карл Вільгельм Шеєле (мал. 30.2) виявив: один з продуктів гідролізу (розкладання під дією води) жирів - гліцерин.
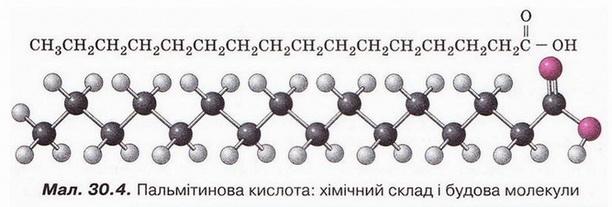
1817 р. його співвітчизник Шеврьоль (мал. 30.3) не лише добув з жирів уже відому «солодку олію Шеєле», яку назвав гліцерином (про походження назви гліцерину йшлося у § 27). Непересічне значення мало відкриття ним у продуктах дії водних розчинів лугів і кислот на різноманітні жири раніше невідомих сполук. Ними виявилися вищі карбонові кислоти - стеаринова (мал. 30.1,1), пальмітинова (мал. 30.4), олеїнова (мал. 30.1,2).
Завдання
Роздивіться малюнок 30.4. Визначте, насиченою чи ненасиченою сполукою є пальмітинова кислота.
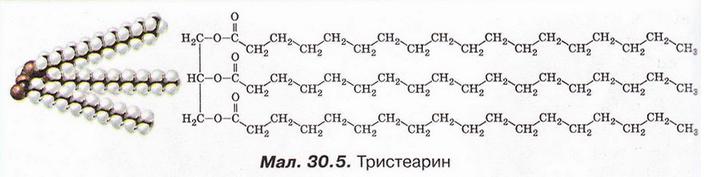
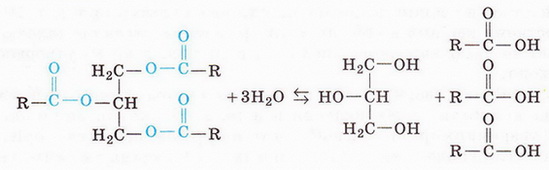
Тобто за результатами аналізу продуктів гідролізу Шеврьоль зміг зробити певні висновки про склад жирів. Сорок років потому Марселен Бертло (див. § 18) встановив структуру гліцерину і з нього та вищих карбонових кислот синтезував жир. Отже, склад і структуру (мал. 30.5) природних жирів було доведено експериментально.
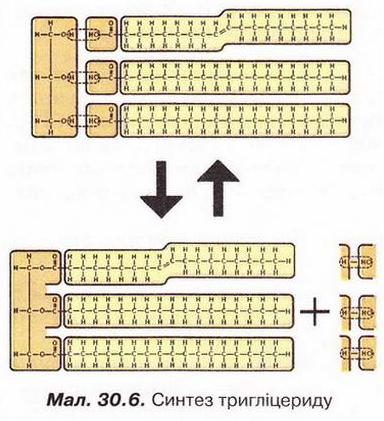
• Перетворення жирів у рослинних і тваринних організмах також відбувається за участю гліцерину й вищих карбонових кислот. Схематично процес утворення жиру на рівні мікросвіту наведено на малюнку 30.6.
Тепер ви зможете зрозуміти, як саме ріпакову, відпрацьовані соняшникову, кукурудзяну олії, тваринні жири тощо переробляють на біодизель (про нього йшлося у § 28). Унаслідок нагрівання етанолу з жиром, приміром тристеарином, за присутності каталізатора утворюються гліцерин і етилстеарат.
Зрозуміло, що склад біодизельного пального залежить від того, який спирт і які жири було використано для його виготовлення:
Завдання
Гліцерин – побічний продукт біодизельного виробництва. Чи правильно вважати його відходом? Аргументуйте свою думку.
У рослинах жири утворюються з вуглеводів (докладніше про них ви дізнаєтеся з наступних параграфів). Цей процес найінтенсивніше відбувається в насінні дозріваючих олійних культур і плодах. Під час проростання насіння жири, навпаки, розщеплюються (за участю ферментів) на вищі карбонові кислоти і гліцерин, з якого утворюються вуглеводи.
В організмах тварин також можливий синтез жирів з вуглеводів. Значна кількість жирів надходить з їжею. У шлунково-кишковому тракті тваринних організмів відбувається гідроліз спожитих жирів. З утвореного гліцерину й вищих карбонових кислот організм синтезує специфічні для нього жири. Продуктами гідролізу запасених жирів є вищі карбонові кислоти. Їхнє окиснення супроводжується виділенням енергії, яку організм витрачає на потреби життєдіяльності. Приміром, запас жиру у верблюжому горбі сягає 120 кг. Унаслідок повного окиснення жиру утворюється вода масою понад 100 кг і виділяється значна кількість енергії.
Унаслідок лужного гідролізу жирів добувають гліцерин і мила - натрієві та калієві солі вищих карбонових кислот:
Тепер зрозуміло, що свого часу Жоффруа дією сильної кислоти на мило - сіль слабкої органічної кислоти - добув суміш вищих карбонових кислот:
Гідроліз жирів та їхній синтез з гліцерину й вищих карбонових кислот - оборотні процеси, які мають непересічне значення в життєдіяльності організмів та суспільному господарстві. Однак широке використання жирів ґрунтується не лише на цих реакціях.
Які ще властивості жирів зумовили їхню біологічну роль і застосування? Про це йтиметься в наступному параграфі.
Стисло про головне
Жири - природна сировина, з якої шляхом хімічних перетворень перше добули вищі карбонові кислоти. Найвідоміші поміж них - насичені пальмітинова С15Н31СООН та стеаринова С17Н35СООН кислоти й ненасичена олеїнова кислота С17Н33СООН. Вони входять до складу стеарину, косметичних засобів. За стандартних умов пальмітинова й стеаринова кислоти перебувають у твердому агрегатному стані й зовні нагадують парафін. Олеїнова кислота - рідина.
Склад і структуру жирів було встановлено за продуктами їхнього гідролізу та шляхом зустрічного синтезу жирів з гліцерину й вищих карго нових кислот:
Унаслідок лужного гідролізу жирів добувають гліцерин і мила - натрієві та калієві солі вищих карбонових кислот.
У шлунково-кишковому тракті тваринних організмів відбувається гідроліз спожитих жирів. З утвореного гліцерину й вищих карбонових кислот організм синтезує специфічні для нього жири. Продукти гідролізу запасених жирів - вищі карбонові кислоти. їхнє окиснення супроводжується виділенням енергії, яку організм витрачає на потреби життєдіяльності. Гідроліз жирів та їхній синтез з гліцерину й вищих карбонових кислот - оборотні процеси, які мають непересічне значення у життєдіяльності організмів та суспільному господарстві.
Вуглеводи: глюкоза, сахароза, крохмаль, целюлоза. Молекулярні формули, фізичні властивості, поширення і утворення в природі
Склад вуглеводів. Назва «вуглеводи» пов’язана зі складом цих сполук. Так, молекули вуглеводів містять атоми Карбону, Гідрогену й Оксигену, при цьому атоми Гідрогену та Оксигену перебувають у тому самому співвідношенні, що й у молекулі води, тобто 2 : 1.
Загальну формулу вуглеводів подають у вигляді Cm(H2O)n.
Вуглеводи поділяють на прості, або моносахариди, та складні, або полісахариди (схема 12).
Схема 12

Глюкоза. Молекулярна формула глюкози — C6H12O6. Вона міститься в рослинах, а саме в плодах, квітках, листі та корінні. Особливо багато її у винограді, цукрових буряках, солодких фруктах та ягодах. Глюкоза входить до складу меду.
Масова частка глюкози в крові людини становить 0,1 %, але у хворих на цукровий діабет вона набагато більша.
За участі груп —OH глюкоза взаємодіє з гідроксидами металічних елементів, зокрема з купрум(ІІ) гідроксидом, з утворенням сполуки синього кольору:

Лабораторний дослід 19
Взаємодія глюкози з купрум(ІІ) гідроксидом
У пробірку налийте розчин купрум(ІІ) сульфату об’ємом 0,5 мл, додайте розчин натрій гідроксиду об’ємом 2 мл. Що спостерігаєте? Осад якої речовини та якого кольору утворюється? Складіть рівняння здійсненої реакції.
До добутого осаду додайте такий самий об’єм розчину глюкози, суміш перемішайте. Що спостерігаєте? Осад розчиняється з утворенням забарвленого розчину. Який колір розчину? Який склад та назва речовини, що розчинилася?
Перетворення, пов’язані з утворенням та розчиненням осаду, виразіть відповідними рівняннями хімічних реакцій. Яку назву має кінцевий продукт взаємодії глюкози з купрум(ІІ) гідроксидом? Усі спостереження, назви речовин запишіть у зошит.
Сахароза — це хімічна назва цукру. Молекулярна формула сахарози — C12H22O11. Її виділяють із цукрових буряків або цукрової тростини. Вона є одним із головних джерел енергії у їжі людини. Сахарозу ще називають дисахаридом, через те що в кислотному середовищі під час нагрівання або під дією ферментів, тобто біологічних каталізаторів, відбувається гідроліз із утворенням молекул двох інших речовин — глюкози та фруктози:

Ці речовини мають однаковий склад, але відрізняються будовою молекул.
Крохмаль. Молекулярна формула крохмалю — (C6H10O5)n. Це біла порошкоподібна речовина, нерозчинна в холодній воді. У гарячій воді крохмаль набухає, утворюючи крохмальний клейстер.
Лабораторний дослід 20
Відношення крохмалю до води
У пробірку шпателем насипте трохи крохмалю й залийте водою об’ємом 4-5 мл. За допомогою скляної палички суміш ретельно перемішайте.
В іншій пробірці нагрійте до кипіння воду об’ємом 2-3 мл. Потім у цю саму пробірку невеликими порціями влийте, перемішуючи, суспензію крохмалю. Що спостерігаєте? Утворюється колоїдний розчин (крохмальний клейстер). Яку назву він має? Колоїдний розчин зберігайте для виконання наступного досліду.
Усі спостереження, назви отриманих продуктів і хід виконання досліду запишіть у зошит.
Крохмаль міститься в рослинах: у картоплі його масова частка наближається до 20 %; у зернах пшениці та кукурудзи — до 70 %, а найбільша в зернах рису — 80 %. Крохмаль відносять до цінних поживних речовин.
В організмі людини під дією ферментів крохмаль зазнає гідролізу з утворенням глюкози:

Молекули крохмалю неоднакові за структурою та розмірами. Молекули лінійної структури (рис. 51, а) складаються з декількох сотен ланок складу C6H10O5. Їхня молекулярна маса становить кілька сотен тисяч г/моль.

Рис. 51. Полімерна будова молекули крохмалю: а — лінійна; б — розгалужена
Молекули розгалуженої структури крохмалю (рис. 51, б) складаються з декількох тисяч ланок C6H10O5, молекулярна маса яких становить кілька мільйонів г/моль.
Під час взаємодії крохмалю з йодом утворюється речовина синього кольору. Її застосовують як якісну реакцію з метою визначення наявності в речовині як йоду, так і крохмалю.

Целюлоза, яку ще називають клітковиною, — волокниста речовина, нерозчинна не тільки у воді, а й в органічних розчинниках. Вона подібно до крохмалю, унаслідок повного гідролізу за умови нагрівання або наявності кислот, перетворюється на глюкозу:

Крохмаль і целюлоза — природні ізомери. На відміну від молекул крохмалю, молекули целюлози не бувають розгалуженими, вони переплітаються між собою, утворюючи волокна (рис. 52).
Целюлоза входить до складу рослинних клітин, головним чином бавовни та льону. Деревина також містить целюлозу, але лише з масовою часткою 50 %.
Лабораторний дослід 21
Взаємодія крохмалю з йодом
Добутий у попередньому досліді крохмальний клейстер об’ємом 1 мл налийте в пробірку. Додайте до нього воду об’ємом 1 мл та 1-2 краплини спиртового розчину йоду. Уміст пробірки ретельно перемішайте скляною паличкою. Розчин забарвлюється. У який колір?
Пробірку з отриманим розчином за допомогою тримача нагрійте в полум’ї спиртівки до кипіння. Забарвлення розчину зникає, але після охолодження знову з’являється.
Біологічне значення й застосування вуглеводів. В організмі людини глюкоза розноситься кров’ю по всьому організму та є для нього основним джерелом енергії.
Глюкозу застосовують у медицині, кондитерському виробництві, бавовняній промисловості (для обробляння тканин), а також у шкіряному виробництві.
Сахарозу використовують головним чином у харчовій промисловості.
Крохмаль, що міститься в таких харчових продуктах, як картопля, хліб, крупи, практично задовольняє потребу людей у вуглеводах. Його застосовують у виробництві антибіотиків, вітамінів, у медицині.
Целюлозу у вигляді деревини використовують як будівельний матеріал, у складі волокнистих матеріалів — для виготовляння канатів, тканин, ниток. Із целюлози виготовляють папір, вату, етанол, штучні волокна та шкіри, пластмаси, лаки, електроізоляційні покриття, негорючі кіноплівки.
Зягяльня схема виробництва цукру
У цукрових буряках міститься в середньому 16-18 % цукру. Добування цукру показано на схемі 13. Насамперед цукрові буряки миють, нарізають за допомогою спеціальних машин на тоненькі шматочки (бурякова стружка) і витягують (видобувають) з них цукор гарячою водою. Це так званий дифузійний спосіб, який ґрунтується на тому, що цукор дифундує крізь клітинну оболонку, тоді як білкові речовини залишаються всередині клітин і не забруднюють розчину цукру. Отриманий розчин випарюють у вакуум-апаратах у декілька прийомів: спочатку, за порівняно невисокого вакууму, — до густини сиропу, а потім, за більшого значення вакууму, — до утворення густої кристалічної маси.
Схема 13

Основні поняття. Вуглеводи. Моносахариди. Полісахариди. Глюкоза. Сахароза. Крохмаль. Целюлоза.
Експериментуємо вдома
Виявлення органічних сполук у харчових продуктах
Проведіть експеримент з виявлення крохмалю в бульбах сирої картоплі. Із цією метою миту обчищену бульбу картоплі подрібніть на тертушці. Потім помістіть її на дрібне сито та промийте водою. Утворена в результаті каламутна рідина — крохмальне молоко. Дайте йому відстоятися та відфільтруйте. Те, що залишилося на фільтрі, є крохмалем.
Якщо набрати крохмальне молоко у звичайну металеву кружку, залити невеликим об’ємом води і, перемішуючи, довести до кипіння, то утвориться крохмальний клейстер. Після охолодження додайте до нього, безперервно перемішуючи, по краплинах спиртовий розчин йоду. Що спостерігаєте? Якого кольору набуває суміш? Зробіть висновок.
Білки: слад і будова. Біологічна роль амінокислот і білків. Природні й синтетичні природні сполуки
Захист довкілля від стійких органічних забруднювачів
ХІМІКАТИ
Економічний розвиток значною мірою залежить від прогресу у хімічній промисловості. За сто років люди навчились виробляти штучні хімічні сполуки (хімікати), якими послуговуються на полях, в промисловості та побуті. Хоча більшість цих хімікатів мають важливе значення для сучасного суспільства, вони є серйозною небезпекою для довкілля та здоров'я людей, адже токсичні речовини викликають отруєння усього організму людини або негативно впливають на окремі системи людського організму.
2. СТІЙКІ ОРГАНІЧНІ ЗАБРУДНЮВАЧІ (СОЗ)
Стійкі органічні забруднювачі – це токсичні органічні речовини (хімікати або побічні продукти) стійкі до розкладання, переносяться на великі відстані від джерела та накопичуються в живих організмах. Біологи називають їх ксенобіотики – по-латинськи чужий (ксено) для довкілля (біоти). Сьогодні на нашій планеті не лишилося території, де б не були виявлені СОЗ.
Негативний вплив стійких забруднювачів:
• проявляють токсичну дію на живі організми, спричиняючи тяжкі захворювання;
• молекули містять атоми хлору, які можуть бути причиною утворення ще більш небезпечних сполук;
• надзвичайно стійкі до хімічного та біологічного розкладення, зберігаються в навколишньому середовищі протягом десятиліть; на них не діють речовини, якими нейтралізують інші забруднювачі, і природні відновні процеси;
• накопичуються в тканинах більшості живих організмів через ланцюг живлення (водорості – планктон – риби – людина, ґрунти – рослини – травоїдні тварини – людина)
• відкладаються в жирових тканинах людей і тварин;
• швидко переносяться повітрям, водою, мігруючими видами тварин по планеті;
• осідають на великій відстані від джерела їхнього викиду, нагромаджуючись у всіх екосистемах;
• потрапляючи в довкілля, порушують природні процеси колообігу речовин та енергії, руйнують озоновий шар атмосфери, ґрунти, підсилюють тепловий ефект тощо.
Приклади СОЗ: пестициди, діоксини, органічні розчинники, технічні речовини, фреони, аерозолі, побічні продукти спалювання та роботи транспорту, підприємств енергетики, хімічних виробництв тощо.
3. СТОКГОЛЬМСЬКА КОНВЕНЦІЯ ПРО СОЗ.
Набула чинності 17 травня 2004 р, що стало початком реальних дій міжнародної спільноти для охорони здоров’я людини та довкілля від шкідливого впливу цих речовин. Україна однією з перших підписала цю міжнародну угоду.
Під час підписання Стокольмської конвенції в 2001 році до переліку було включено 12 сполук:
Пестициди
|
Дихлор-дифеніл-трихлоретен (ДДТ), альдрин, діельдрин, ендрин, хлордан, мірекс, токсафен, гептахлор
|
Технічні продукти (діалектрики, пластифікатори)
|
Гексахлорбензол (ГХБ), поліхлоровані біфеніли (ПХБ.)
|
Побічний продукт хлорування та спалювання органічних сполук
|
Поліхлордібензодіоксин (ПХДД) та поліхлордібензофуран (ПХДФ).
|
Визначення "брудна дюжина" є більш емоційним, ніж науковим, оскільки кількість таких сполук постійно змінюються.
У травні 2009 року (зміни вступили в силу 26.08.2010 р.) в Женеві було прийняте рішення про включення в Конвенцію 9-ти нових СОЗ: хлордекону, гексабромдифенілу, альфа-гексахлорциклогексану, бета-гексахлор-циклогексану, ліндану (гамма-гексахлорциклогексану), пентахлорбензолу, тетрабромдифенілового та пентабромдифенілового ефірів, гексабромдифенілового та пентабромдифенілового ефірів, перфтороктанового сульфонату, кислоти, солей і перфтороктанового сульфонілфториду.
На конференції сторін в 2011 році до переліку було включено ендосульфан (технічний та ізомери).
На сьогодні загальна кількість СОЗ, які є предметом дослідження Стокгольмської конвенції, складає як мінімум 36 сполук (8 пестицидів, 7 ПХДД, 10 ПХДФ і 11 ПХБ).
Кандидатами на включення в Конвенцію на даний час також є: гексабромциклододекан, хлорованні парафіни з коротким ланцюгом, гексахлорбутадієн, пентахлорфенол та хлоровані нафталіни.
Конвенція передбачає:
• заборону виробництва і використання, імпорту або експорту 12 найбільш небезпечних СОЗ, так званої «брудної дюжини»;
• обмеження виробництва і використання ДДТ (залишається засобом боротьби з малярією поки не винайдуть альтернативні запобіжні методи, завдання по захисту довкілля полягає у припиненні його застосування в сільському господарстві) та ПХБ;
• розробку національної стратегії щодо зменшення або ліквідації викидів СОЗ як продуктів ненавмисного утворення;
• сприяння впровадженню найкращих методів утилізації та знешкодження СОЗ, наявних у сховищах.
Додаткові документи:
• Конвенція про заборону розробки, виробництва, накопичення, застосування хімічної зброї та про її знищення.
• Конвенція про безпеку в застосуванні хімічних речовин на виробництві.
• Конвенція про боротьбу з небезпекою, спричинюваною канцерогенними речовинами й агентами у виробничих умовах, та заходи профілактики.
4. ГРУПИ СТІЙКИХ ОРГАНІЧНИХ ЗАБРУДНЮВАЧІВ
1) ПЕСТИЦИДИ – (від лат. реstis - зараза і саейо – вбиваю) – узагальнена назва хімічних сполук, які використовують для боротьби зі шкідливими організмами (знищення бур’янів, гризунів, комах, для боротьби зі шкідливими кліщами, попелицями, із ґрунтовими паразитичними хробаками та для захисту рослин від грибкових захворювань), або більш вузьке поняття хімічні засоби захисту рослин (ХЗЗР).
За впливом на певні групи організмів розрізняють: гербіциди (знищують сміттєву рослинність), дефоліанти (пришвидшують опадання листя), інсектициди (знищують комах), акарициди (знищують кліщів), фунгіциди (знищують гриби), зооциди (знищують теплокровних тварин), родентициди (знищують гризунів), нематоциди (знищують круглих червів, або нематод).
2) ТЕХНІЧНІ ПРОДУКТИ.
 |
промислові продукти, які використовуються у старих технічних приладах (електролітичні конденсатори, трансформатори). ПХБ утворюється при спалюванні сміття. ГХБ використовується у піротехнічних засобах, як фунгіцид або інсектицид
|
3) ДІОКСИНИ ТА ІНШІ.
 |
спеціально не виробляються і на даний час ніде не використовуються, є універсальною отрутою, яка діє на клітинному рівні та вражає всі види тварин і більшість рослин. Утворюються при процесах хлорування та спалювання природного палива. Мікробіологічне розкладання сміття при підвищеній температурі також супроводжується виділенням зазначених речовин
|
5. АКТУАЛЬНІСТЬ ПРОБЛЕМИ.
Актуальність проблеми стійких органічних забруднювачів у нашій країні зумовлена такими чинниками:
• розвинене сільськогосподарське виробництво;
• висока питома вага енергетичних установок комунальної та промислової сфери, на яких спалюють ті чи інші види палива;
• металургійний сектор економіки (виробництво алюмінію та інших кольорових металів, чавуну, сталі);
• невідповідне поводження з накопиченими непридатними й забороненими пестицидами та реального їх знешкодження.
• процеси спалювання в побутовому секторі (спалювання відходів, у тому числі одночасне спалювання на сміттєспалювальних заводах великих міст);
• специфічні процеси хімічного виробництва, під час яких утворюються проміжні хімічні сполуки і побічні продукти;
• значна кількість застосовуваних технологій і виробництв є застарілими й потребують модернізації.
6. ЗАГАЛЬНІ МЕТОДИ ДЛЯ ЗМЕНШЕННЯ ВМІСТУ СОЗ.
• Обмеження викидів хлоровмісних сполук промисловими підприємствами.
• Упровадження природоохоронної діяльності та регулювання її.
• Раціональне господарювання у сфері профілактичних заходів.
• Очищення навколишнього середовища механічними методами (виокремлення грубих домі шків стійких забруднювачів за допомогою відстійників, сит, фільтрів), хімічними методами (до забруднювачів додають речовини, які знешкоджують їх) й біологічними методами (очищення стічних вод, ґрунтів аеробними бактеріями, які розкладають речовини-забруднювачі на вуглекислий газ і воду).
• Рециркуляція, утилізація відходів.
• Пряме, повторне чи альтернативне використання.
• Заміну сировинних матеріалів, які є стійкими органічними забруднювачами, на безпечніші.
• Максимальне зменшення цих речовин у продуктах харчування.
• Уникання використання елементного хлору або хімічних речовин, що утворюють елементний хлор тощо.
• Інвентаризація та безпечне знищення з дотриманням норм санітарно-епідеміологічного та природоохоронного законодавства заборонених речовин.
Будова речовини. Багатоманітність речовин та хімічних реакцій
Будова речовин. Речовина — це одна з основних форм існування матерії. Частинками, що входять до складу речовин, є атоми і молекули. Усі речовини — це сполуки хімічних елементів, які являють собою певні типи атомів.
За будовою речовини відрізняються одна від одної елементним складом, тобто відносним вмістом у молекулі або кристалі атомів певного типу, їхнім взаємним розташуванням, а також загальним числом атомів у молекулі.
Тверді речовини бувають кристалічними та аморфними.
Кристалічними називають тверді речовини, для яких характерне суворо упорядковане розташування частинок, що утворюють цю речовину та коливаються відносно деяких точок рівноваги.
Аморфними називають речовини, у яких немає суворо упорядкованого розташування частинок. За внутрішньою будовою вони подібні до рідин, які мають дуже високу в'язкість.
Характерною особливістю будови кристалічних речовин є неоднаковість їхніх механічних, теплових, електричних, оптичних властивостей за різними напрямками. Наприклад, якщо з кубічного кристалу натрій хлориду вирізати два бруски: один перпендикулярно до граней куба, другий по діагоналі однієї із граней — та дослідити їх на розрив, то для розриву другого бруска знадобиться сила, удвічі більша, ніж для розриву першого бруска.
Іншою особливістю кристалічних речовин, яка відрізняє їх від аморфних, є суворо визначена температура плавлення.
Кристалічні ґратки розрізняють за характером частинок у вузлах і за характером зв'язку між ними.
Йонні кристалічні ґратки містять у вузлах йони з протилежним знаком. Зв'язок між ними не має специфічної направленості й обумовлений їхньою електростатичною взаємодією.
Молекулярні кристалічні ґратки містять у вузлах молекули речовин ковалентної природи, тобто таких, що складаються з атомів, сполучених один з одним ковалентними зв'язками. Для речовин з молекулярними кристалічними ґратками властиві невелика механічна міцність, досить значна леткість та низькі температури плавлення.
Атомні кристалічні ґратки містять у вузлах атоми багатовалентних елементів, які сполучені один з одним міцними ковалентними зв'язками. Такі кристалічні ґратки характерні для невеликої кількості речовин: вуглецю, силіцію, германію, бору. Атомним кристалам притаманні дуже велика твердість і висока температура плавлення.
Багатоманітність речовин і хімічних реакцій. Хімічні елементи утворюють велику кількість простих і складних речовин (схема 15). Прості речовини складаються з атомів одного елемента, а складні — з атомів двох або більшої кількості елементів.
Прості речовини, своєю чергою, залежно від типу хімічного зв'язку між їхніми атомами, поділяють на метали та неметали. У металів тип хімічного зв'язку між атомами — металічний, у неметалів — ковалентний. Серед відомих на цей час 118 елементів 83 є металами.
Хоча прості речовини побудовані з атомів тільки одного елемента, той самий елемент може утворювати декілька простих речовин.
Схема 15

Складні багатоелементні речовини поділяють:
• за кількістю елементів, що входять до їхнього складу, на групи: бінарні (HCl) та інші (K2CO3, NaHSO4);
• за хімічними властивостями в хімічних реакціях на класи: оксиди, кислоти, основи, амфотерні гідроксиди, солі. Цю класифікацію неорганічних речовин розробили видатні хіміки XVIII—XIX ст. А. Л. Лавуазьє, М. В. Ломоносов, Й. Я. Берцеліус, Дж. Дальтон;
на вуглеводні, спирти, карбонові кислоти, жири, білки, вуглеводи тощо у разі органічних речовин.
Взаємозв'язки між речовинами та їхні взаємоперетворення відображають у вигляді рівнянь хімічних реакцій.
Розглянемо перетворення, наприклад, сполук Феруму в прямому і зворотному напрямках:
FeSO4 → FeCO3 → FeCl2 → Fe(OH)2 → Fe(NO3)2 — прямі перетворення;
Fe(NO3)2 → Fe(OH)2 → FeCl2 → FeCO3 → FeSO4 — зворотні перетворення.
Прямі перетворення охарактеризуємо такими рівняннями реакцій:
1) FeSO4 + Na2CO3 = FeCO3↓ + Na2SO4
2) FeCO3 + 2HCl = FeCl2 + 2H2O + CO2↑
3) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
4) Fe(OH)2 + 2HNO3 = Fe(NO3)2 + 2H2O
Зворотні перетворення можна подати такими хімічними рівняннями:
1) Fe(NO3)2 + 2NaOH = Fe(OH)2↓ + 2NaNO3
2) Fe(OH)2 + 2HCl = FeCl2 + 2H2O
3) FeCl2 + Na2CO3 = FeCO3↓ + 2NaCl
4) FeCO3 + H2SO4(розв.) = FeSO4 + H2O + CO2↑
Запитання та завдання
- 1. Що таке речовина?
- 2. Як класифікують тверді речовини?
- 3. Які речовини називають: а) кристалічними; б) аморфними?
- 4. Як класифікують кристалічні речовини за типом кристалічних ґраток?
- 5. Який тип кристалічних ґраток називають: а) йонним; б) молекулярним; в) атомним; г) металічним?
- 6. Як називають речовини, що складаються з атомів лише одного елемента?
- 7. Як поділяють прості речовини залежно від виду хімічного зв'язку між атомами?
- 8. Чи може той самий елемент утворювати кілька простих речовин? Чим це обумовлено? Наведіть приклади.
- 9. За яким фактором складні речовини поділяють на класи?
- 10. Які класи неорганічних речовин є найважливішими?
- 11. Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) CuCl2 → Cu(OH)2 → CuSO4 → Cu → CuO → Cu(NO3)2;
б) N2 → NH3 → (NH4)2SO4 → NH4Cl → NH3 → (NH4)3PO4 → NH4Cl;
в) Na → NaOH → NaHCO3 → Na2CO3 → NaCl → NaNO3.
- 12. Як із кальцій карбонату добути барій карбонат? Складіть рівняння реакцій.
- 13. Як отримати кальцій хлорид із кальцій нітрату, використовуючи калій карбонат і хлоридну кислоту? Складіть рівняння реакцій.
- 14. Як із купрум(ІІ) нітрату отримати купрум(ІІ) хлорид? Напишіть рівняння реакцій.
- 15. Запропонуйте три способи отримання карбон(ІІ) оксиду (вуглекислого газу).
- 16. Визначте ланку, якої бракує в ланцюжку, що характеризує генетичний зв'язок речовин:
а) S → ? → H2SO3 → CaSO3;
б) Fe → Fe2O3 → Fe(OH)3;
в) Са → ? → ? → Ca(NO3)2;

- *17. Нижче наведено пари речовин:
а) оксид металічного елемента та водень;
проста речовина та кисень;
активний метал і кислота;
б) основний оксид і вода;
кислотний оксид і вода;
основний оксид і кислота;
в) основа та кислота;
основний і кислотний оксиди;
кислотний оксид і луг;
г) сіль і луг;
сіль і кислота;
сіль і сіль.
Речовини яких класів утворюються в результаті їхньої взаємодії? Наведіть приклади.
- *18. Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення речовин:
крохмаль → глюкоза → карбон(IV) → оксид → глюкоза.
Місце хімії серед наук про природу, її значення для розуміння наукової картини світу
З наук про природу ви ознайомилися з фізикою, ботанікою, зоологією, анатомією й фізіологією людини та хімією. Серед цих наук хімія посідає центральне місце. Вона тісно пов’язана як з фізикою, так і з біологією, причому питання, спільні для фізики та хімії, розглядаються у спеціальних науках – хімічній фізиці та фізичній хімії; питання, які спільні для хімії й біології – у біохімії. Під час хімічних реакцій виникають різні фізичні явища: виділяється або вбирається тепло, випромінюється світло, змінюється фізичний стан речовин. Багато хімічних перетворень відбувається під дією фізичних факторів: теплоти, світлового випромінювання, електричного струму, тому хіміки у своїх дослідженнях весь час спираються на фізичні методи дослідження та на фізичні теорії. З молекулярної теорії розробленої у фізиці, розвинулась атомістична теорія, яка стала для хіміків провідною у розкритті внутрішньої суті хімічних перетворень речовин, розкрита фізична суть періодичного закону.
У свою чергу, біологічні процеси нерозривно зв’язані з хімічними реакціями, що відбуваються в живих організмах. Кожний рух думки, кожне скорочення м’яза пов’язане з складними хімічними перетвореннями в нервовій й м’язовій тканинах. Біологічний обмін зумовлений послідовними хімічними реакціями: утворення білків, жирів й вуглеводів у клітинах, ріст, розмноження, процеси травлення, та інші. У кожній клітині нашого організму відбувається понад три тисячі хімічних реакцій. Процес фотосинтезу – головна хімічна реакція на поверхні нашої планети, яка є основою життя на землі. Реакції окиснення органічних речовин, добутих у процесі фотосинтезу, відіграють роль важливого джерела енергії для всіх живих організмів. Тому хімія, хімічні методи дослідження і хімічні теорії подають велику допомогу біології в розв’янні її проблем, аж до пояснення механізму спадковості.
Знання хімії дає розуміння наукової картини світу. Сучасна наукова картина світу – це цілісна система уявлень про загальні властивості й закономірності природи. Вона є результатом синтезу знань з різних наук, включає уявлення про природу, життя суспільства. Хімічна картина світу – це фрагмент матеріального світу, але без неї не можливо отримати загальне уявлення про світ.
Оточуючий нас світ реально існує, підкоряється своїм законам, які не залежать від волі людини. Людина лише в міру розвитку науки має можливість все глибше проникати у таємниці світу.
Світ матеріальний. Все що нас оточує являє собою різні види матерії, яка перебуває у постійному русі, змінах й розвитку. Одні форми руху матерії можуть переходити в інші: механічний рух у тепловий, тепловий у хімічний. При цьому зберігається основний закон природи – закон вічності матерії й руху.
Хімія, як наука про речовини і їх перетворення, має важливе значення для пояснення основи наукової картини світу. Не можна зрозуміти процеси, які відбуваються в пророді не знаючи основних законів хімії, які керують цими процесами, навіть поза нашим впливом на них.
Колись люди користувалися тим, що їм давала пророда. Тепер, знаючи явища пророди, люди, підкорили її, створили нові речовини. Хімія пояснює будову речовин, допомагає застосувати знання для добування речовин із заданими властивостями. Знання хімії наближають нас до розуміння Всесвіту та його різноманітних явищ.
Багато уявлень про речовини та їхні перетворення в міру розвитку пізнання й практики змінювались. Так, атомно-молекулярне вчення, розроблене всередині XVIII століття, мало велике значення для утвердження наукового погляду на картину світу. Проте з розвитком науки виявилось, що не всі речовини складаються з молекул, у багатьох речовин атомна або йонна будова. На підставі наукових поглядів хімічна картина світу змінилась, стала досконалішою.
Перші синтези органічних речовин із неорганічних завдали поразки віталістичному вченню. Після відкриття Д. І. Менделеєвим періодичного закону та періодичної системи та розробки О. М. Бутлеровим структурної теорії, природу почали розглядати як комплекс взаємозв’язаних предметів та явищ, які перебувають у постійному русі, змінюються, розвиваються.
Успіхи у вивченні явища радіоактивності та будови атома дали змогу розв’язати питання про штучне створення та цілеспрямоване перетворення хімічних елементів. Тим самим було внесено зміни в наукове розуміння картини світу.
Нові наукові відкриття внесли певні зміни у розуміння наукової картини світу. Горький писав: «Її (хімії) зіркий, сміливий погляд проникає у вогняну масу Сонця, у темряву земної кори, у невидимі частинки нашого серця, в таємницю будови каменя, у безмовне життя дерева. Вона дивиться навколо й відкриваючи гармонію, шукає початок життя».
Хімія та екологія
Хімія та екологія
Екологія – це наука про відносини організмів між собою та з довкіллям.
Головними забрудниками довкілля є теплоелектростанції, кольорова металургія, транспорт. Наприклад, щороку в атмосферу викидається 100 млн. тон сульфур(IV) оксиду SO2. Більше половини цієї кількості припадає на частку теплоелектростанцій, чверть – на частку кольорової металургії і лише кілька відсотків – на частку чорної металургії та основної хімічної промисловості. Те саме можна сказати про викиди оксидів нітрогену та вуглекислого газу, про тверді пилові викиди і канцерогенні мікроелементи.
З метою захисту довкілля в хімічній промисловості використовують різні фільтри, пилогазовловлювачі, які значно зменшують викидання шкідливих речовин в атмосферу.
Синтетичні полімери на відміну від природних не розкладаються ферментами і залишаються в природі. Коли ж їх після використання спалюють, то тим самим лише збільшують забруднення повітря. Перед хіміками стоїть завдання розробки способів утилізації синтетичних матеріалів і створення нових полімерів, які б розкладалися в природі.
Дуже гостро постала проблема раціонального використання води і неприпустимості забруднення водойм. При цьому враховують, що прісна вода становить тільки близько 2,5 % від загальної кількості води на Землі. Кардинальне розв’язання проблеми полягає у створенні замкнених (безстічних) технологічних систем, коли використана вода очищується і знову повертається у виробництво.
Хімічна наука і виробництво в Україні
Значення хімічного виробництва. Під впливом науково-технічного прогресу хімічні виробництва стали одними з провідних у світовому господарстві на рівні з електроенергетикою та машинобудуванням. Спеціально добуті хімічні речовини люди почали використовувати в епоху Середньовіччя, коли лікарі застосовували різні настоянки, порошки та мазі. У ХVІІ ст. промислових масштабів у Європі набуло виробництво парфумів. У ХІХ ст. у зв’язку з бурхливим ростом виробництва, зріс попит на мінеральні добрива, фарби, соду. Але небувалих масштабів розвиток хімічних виробництв набув у ХХ ст. За цей проміжок часу було синтезовано понад 400 тисяч хімічних речовин, яких не існує у природі. На диво, потреба у продукції хімічної промисловості не зменшується, а весь час зростає. Щороку з’являється понад 3 тисячі нових речовин. Одержані речовини настільки різні за своїм складом та технологією виробництва, що промислова хімія нині – це складана індустрія, яку називають комплексом хімічних виробництв.
Хімічне виробництво (хімічна промисловість) – система виробництв важкої промисловості, включаючи синтез речовин з певними властивостя ми, що використовують мінеральну, органічну та іншу сировину шляхом її хімічної переробки. Хімія є дуже наукомістким виробництвом. Завдяки науковим дослідженням одержують матеріали із заздалегідь заданими властивостями, які за своїми якостями перевершують натуральні продукти. З одного боку, широка хімізація господарства дає змогу заощаджувати природні матеріали, але з іншого, речовини, яких не існує у природі, не розкладаються. Тому не лише відходи хімічного виробництва, а й його продукція є значними забруднювачами довкілля. Нині речовини, добуті хімічним шляхом, так тісно увійшли у наше життя, що уявити сучасний світ без продукції хімічної промисловості вже не можливо. Їх застосовують що денно і практично скрізь: у сільському господарстві, енергетиці, легкій та харчовій промисловості, будівництві, медицині, виробництві космічної техніки, у сфері послуг та побуті. Сучасні тенденції розвитку хімічного виробництва. Хімічне виробництво продовжує розвиватися. Синтезуючи все нові й нові речовини, людина залучає у виробництво нові джерела сировини. Освоюючи нові виробництва, хімія сприяє розвитку інших виробництв. Із застосуванням мінеральних добрив, біостимуляторів, кормових добавок, гормонів зростає продуктивність сільського господарства. Сучасні технології хімічної обробки речовин мають великі переваги перед старою механічною обробкою. Це дає змогу використовувати у виробництві фактично будь-які речовини. Хімічна промисловість нині стала занадто соціально орієнтованою, оскільки її продукція безпосередньо застосовується людиною у повсякденному житті: під час прибирання квартири, прання, приготування їжі, знезаражування питної води. Таке глибоке занурення людини у світ хімічних речовин часто має зворотний бік: вражаючі масштаби забрудненого довкілля та невідомі раніше хронічні хвороби.
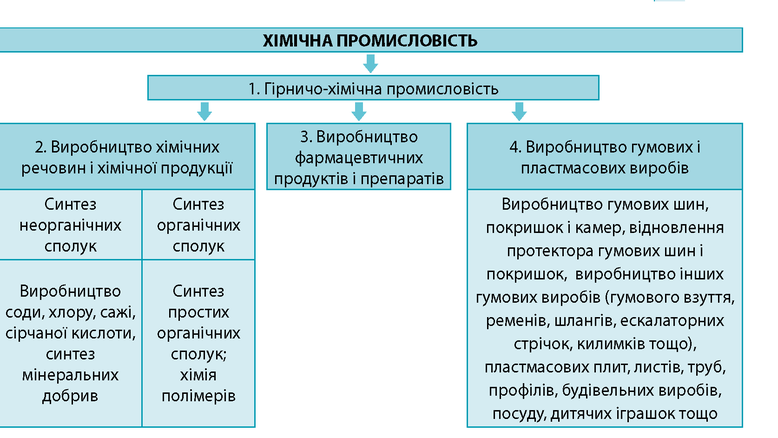
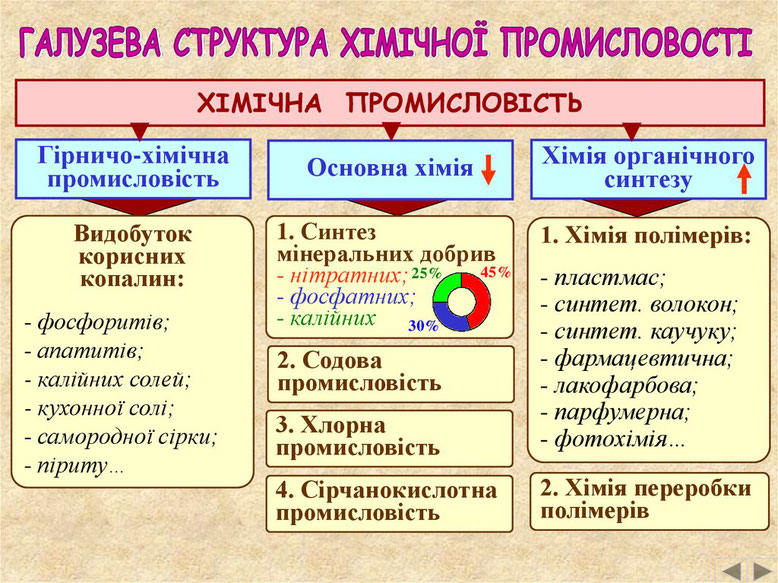
Склад хімічного виробництва. Хімічна промисловість має дуже складну виробничу структуру. Вона охоплює близько 200 взаємопов’язаних виробництв, які об’єднані у чотири групи: гірничо-хімічна промисловість, виробництво хімічних речовин і хімічної продукції, виробництво фармацевтичних продуктів і препаратів, виробництво гумових і пластмасових виробів.
Гірничо-хімічна промисловість формує сировинну базу для розвитку хімічних виробництв, передусім основної хімії. Сировина для хімічної промисловості має вирішальне значення. Її частка у собівартості готової продукції коливається від 45% до 90%. Наприклад, витрати сировини на 1 т ацетилену становлять 4,5 т, амоніаку з коксу – 5,5 т. Оскільки гірничо-хімічна промисловість займається видобутком мінеральних ресурсів, її розміщення пов’язане з родовищами нерудної хімічної сировини.
Виробництво хімічних речовин і хімічної продукції об’єднує синтез мінеральних добрив, барвників і пігментів, промислових газів (зокрема, хлору), пластмас, синтетичного каучуку, фарб і лаків, мийних, парфумерних і косметичних засобів, вибухових речовин, штучних і синтетичних волокон тощо. У цій сфері часто одержують речовини-напівфабрикати, які використовуються для подальшої переробки як всередині хімічної промисловості, так і в інших виробництвах. Виробництво фармацевтичних продуктів і препаратів, як найбільш наукомістке у наш час, розвивається найшвидшими темпами. Воно забезпечує медичні заклади та населення ліками, вітамінами, еластичними бинтами, антисептиками тощо. Виробництво гумових і пластмасових виробів включає одержання гумових шин, покришок і камер, відновлення протектора гумових шин і покришок, виробництво інших гумових виробів (гумового взуття, ременів, шлангів, ескалаторних стрічок, килимків тощо), пластмасових плит, листів, труб, профілів, будівельних виробів, посуду, дитячих іграшок із пластмас.
Природно-сировинна база та використання відходів. Хімічна промисловість використовує дуже широку сировинну базу – практично необмежений перелік речовин. Природною сировиною для хімічної індустрії є перш за все нерудні корисні копалини. Найчастіше видобувають кухонну, калійні та глауберову солі, фосфорити, апатити, самородну сірку. Також у ряді виробництв за стосовують мінеральну сировину, яка використовується в інших сферах діяльності. Так, у хімії органічного синтезу широко застосовують природні вуглеводи. Раніше переробляли кам’яне та буре вугілля, торф та горючі сланці. Нині відбувся перехід до нафти і природного газу. Для одержання фарб застосовують титанові руди, сірчаної кислоти – мідну руду пірит (сірчаний колчедан).
Окрім корисних копалин природною сировиною для хімічної промисловості можуть бути різноманітні тіла та речовини з навколишнього світу: деревина, атмосферне повітря, вода тощо. Вода у хімічній промисловості потрібна не лише для технологічних потреб, а й як сировина, що входить до складу різних сполук. Хімічна промисловість частіше, ніж інші види господарської діяльності використовує для переробки відходи інших виробництв. Так, з коксового газу одержують нітратні добрива, з відходів кольорової металургії – сірчану кислоту. Це водночас дає змогу разом з утилізацією відходів розв’язува ти екологічні проблеми. Особливістю хімічної промисловості є те, що одну й ту саму речовину можна добути з різної сировини. Наприклад, синтетичний каучук можна синтезувати з нафти, кам’яного вугілля, деревини, відходів харчової промисловості тощо. Водночас за рахунок комплексної переробки сировини з однієї сировини можна одержати різні речовини. Так, результатом хімічної переробки нафти можуть бути понад 70 видів продукції.
Виробництво хімічних речовин і хімічної продукції. Найбільш важливими є виробництва, які синтезують неорганічні сполуки (содова, хлорна, сажова, сірчанокислотна промисловість, виробництво мінеральних добрив) та синтез органічних сполук (багатопрофільне виробництво, яке складається із синтезу простих органічних сполук та хімії полімерів).
Содова промисловість – матеріало- та енергомістке виробництво. Щоб одержати 1 т соди, необхідно витратити по 1,5 т кухонної солі та вапняків, а для нагрівання розсолу – 1,7 т умовного палива. Ось чому таке виробництво зорієнтоване на сировинний та паливно-енергетичний чинники. Іноді використовують суху кам’яну сіль, в інших випадках – рідкі розсоли солоних озер або заток. Синтезують харчову, кальциновану та каустичну соду. Харчова сода застосовується у харчовій промисловості, медицині, хімічній (для виробництва пінопласту, фарбників, побутової хімії), легкій промисловості (для штучної шкіри, гуми для підошв, текстилю), входить до складу порошків для гасіння пожеж. Інші види соди є отруйними. Вони йдуть на виробни цтво мила, паперу, скла, глинозему.
Хлорна промисловість працює на відходах содового виробництва. Через те центри їх розвитку часто поєднано. При синтезі хлору з кухонної або калійної солей шляхом електролізу (розкладу речовини під дією електричного струму) виробництво наближене до джерел електроенергії та води. Хлор одержують для виробництва отрутохімікатів, вибілювачів, целюлози та паперу, як знезаражувальний засіб.
Сірчанокислотна (сульфатно-кислотна) промисловість виробляє продукцію, яка має широке застосування та низьку матеріаломісткість виробництва. Сірчана кислота використовується у текстильній, харчовій, нафтопереробній, целюлозно-паперовій промисловості, у виробництві акумуляторів тощо. Проте основним «споживачем» кислоти є синтез фосфатних добрив – суперфосфату. Сірчанокислотна промисловість використовує широку сировинну базу: самородну сірку, пірит, відходи коксохімічних та нафтопереробних заводів, газуваті сполуки Сульфуру, що утворюються під час виплавлення кольорових металів (міді, цинку, нікелю, ртуті). Через високу хімічну активність сірчану кислоту важко перевозити. Для цього потрібний спеціально обладнаний транспорт. Тому її виробництво орієнтується на чинник споживача, тобто ті підприємства, що використовують її у своєму виробничому процесі. Саме тому зазвичай поєднано центри синтезу фосфатних добрив та виробництва сірчаної кислоти.
Сажова промисловість спрямована на добування порошкоподібного вуг лецю, який на 90% складається з Карбону. Сажу одержують під час не повного спалювання чи термічного розкладу природного газу, нафти або вугілля. Через те виробництво зорієнтоване на чинник сировини або за її відсутності – на транспортний чинник. Використовують сажу як чорний пігмент для одержання друкарської фарби, інших фарб, як наповнювач у виробництві гуми.
Для потреб сільського господарства хімічна промисловість синтезує три основні види добрив: калійні (забезпечують імунітет рослин від хвороб та опір проти шкідників), фосфатні (забезпечують раннє цвітіння і плодоносіння) та азотні, або нітратні (стимулюють активний ріст пагона).
Виробництво калійних добрив – дуже матеріаломістке виробництво, отже, розміщене з орієнтуванням на сировинний чинник – родовища калійних солей. Найпоширенішими калійними добривами є сильвініт та калій хлорид, основним складником яких є калійна сіль. Вони виглядають як порошок рожевого кольору. Під час спалювання органічних решток одержують інший вид калійних добрив – поташ. Сировиною для синтезу фосфатних добрив є фосфорити та апатити. Найвідоміші фосфатні добрива – це суперфосфат та фосфоритове борошно. Для одержання суперфосфату фосфорити обробляють сірчаною кислотою, яку важко перевозити. Тому підприємства із синтезу суперфосфату поєднано з центрами виробництва сірчаної кислоти. Крім того, під час розміщення заводів фосфатних добрив враховують чинник споживача – сільське господарство, яке культивує рослини, що потребують для нормального розвитку цих добрив.
Найпоширеніші азотні (нітратні) добрива – селітри та карбамід. Відомі калійна, натрієва та амонійна селітри. Зовні це гранули яскраво білого кольору. Виробництво азотних добрив матеріало-, водо- та енергомістке виробництво. Воно вирізняється великим розмаїттям вихідної сировини, тому й різними чинниками розміщення. Азотні добрива можна одержувати або з відходів коксування вугілля (коксовий газ), або в результаті переробки природного газу чи нафти. Через те виробництво налагодже но або у районах розвитку чорної металургії, або біля нафтогазових родовищ. Якщо немає поблизу джерел природного газу чи нафти, то заводи азотних добрив зорієнтовані на транспортний чинник, найчастіше вони розміщені біля магістральних трубопроводів.
У наш час зростає значення хімії полімерів – синтезу складних високомолекулярних органічних сполук. Найбільш відомі виробництва пластмас та синтетичних смол, поліетилену та поліпропілену, латексу та синтетичного каучуку. До 30-х рр. ХХ ст. використовували лише дорогий натуральний каучук, який добували із соку каучуконосного дерева – гевеї. Перший синтетичний каучук одержали з картоплі, а нині його синтезують з нафти, природного газу, лісової сировини. Більша частина каучуку витрачається на виробництво шин.
Із синтетичних полімерів формують хімічні волокна, які є сировиною для виробництва тканин, а також використовуються у виробництві шин, авіабудуванні тощо. Їх добавляють до натуральних волокон (бавовняних, шовкових, лляних, вовняних), оскільки вони мають ряд переваг. По-перше, для їх виробництва є широка сировинна база. По-друге, їх виробництво достатньо дешеве. По-третє, вони міцніші та не мнуться, не пошкоджу ються комахами та гризунами. Виробництво полімерів потребує великих витрат води та електроенергії. Так, на 1 т хімічного волокна використовується 3–5 тис. м3 води та 5–20 тис. кВт· год електроенергії. Ось чому провідними чинниками в розміщенні підприємств полімерної хімії є окрім сировинного наявність води та електростанції. Крім того, враховується чинник споживача. Наприклад, центри виробництва хімічних волокон зазвичай поєднано з текстильними комбінатами, а шинні заводи – з виробництвом синтетичного каучуку.
Лакофарбова промисловість для свого виробництва використовує різну сировину та напівфабрикати: продукти нафтопереробки, переробки деревини, олійно-жирової промисловості, відходи металургії. Лакофарбові матеріали (лаки, фарби, емалі, оліфи, розчинники) мають здатність після нанесення на поверхню створювати декоративну або захисну плівку. Через те вони слугують як для оздоблення, так і для захисту матеріалів від руй нування: металу – від корозії, дерева – від гниття. Підприємства лакофарбового виробництва орієнтуються на чинник споживача. Парфумерна промисловість використовує як природну, так і синтетичну сировину. Основою для рідких парфумів є етиловий спирт і дистильована вода, до яких добавляють духмяні речовини рослинного або синтетичного походження. Найвідоміші рослинні олії одержують з пелюсток троянд, листя м’яти, лаванди, сандалового та кедрового дерева тощо. Частиною парфумерної є миловарна промисловість. Виробництво парфумів зорієнтоване на чинники наукової бази та споживача.
Виробництво фармацевтичних продуктів і препаратів. Фармацевтична промисловість посідає одне з найважливіших місць у хімічній індустрії сьогодення. Вона займається дослідженням, розробкою, масовим виробництвом та поширенням лікарських засобів. Важливими чинниками розміщення цієї галузі є наявність наукової бази та споживача. Більшість ліків проходять тривалі систематичні дослідження, що їх проводять фахівці дослідних інститутів та промислових лабораторій. До них залучені учені різного фаху та практикуючі лікарі. Мета досліджень – вивчити ступінь ефективності та водночас токсичності лікарських засобів. У деяких країнах, наприклад Швейцарії, питома вага фармацевтичних виробів у загальному обсязі хімічної продукції становить майже половину.
Принципи розміщення основних виробництв хімічної промисловості. Розглянувши окремі виробництва хімічної промисловості, ви помітили, що на розміщення підприємств впливають такі чинники, як сировинний, па ливно-енергетичний, водний, наукової бази та споживача. Особливе значення має екологічний чинник, який передбачає винесення небезпечних підприємств за межі густо населених територій. Значними витратами сировини вирізняються содова промисловість і синтез мінеральних добрив. У промисловості органічного синтезу на один і той самий продукт одразу затрачається кілька видів сировини.
При виробництві деяких видів синтетичної продукції витрачається багато електроенергії та води, тому часто підприємства орієнтують одночасно на паливно-енергетичний та водний чинники. Такими є виробництво хлору, пластмас, хімічних волокон.
Чинник споживача є провідним під час розміщення підприємств з виробництва сірчаної кислоти та хімії переробки полімерів. Він також враховується у виробництві мінеральних добрив (крім калійних).
На форми розташування хімічної промисловості впливає технологічний чинник. Якщо виробництва не передбачають внутрішньогалузеве комбінування і являють собою технологічно самостійні спеціалізовані підприємства, то вони розміщуються поодинці. Такими є виробництва калійних добрив, фарб, лаків, з переробки пластмас. Навпаки, якщо комбінування є необ хідною умовою функціонування підприємств хімічної промисловості або ви робництв різних напрямів, їхнє розміщення має форму взаємопов’язаних виробництв-комплексів. Такими є нафтохімічні комплекси, що виробляють полімерні матеріали та напівфабрикати для їхнього одержання, барвники та неорганічні хімікати. Поряд розташовуються виробництва сірчаної кислоти та фосфатних добрив, заводи з коксування вугілля та синтезу фосфатних добрив, підприємства кольорової металургії та сірчанокислотні.
Вплив хімічної промисловості на довкілля. Галузі хімічної промисловості значно забруднюють навколишнє середовище як відходами виробництва, так і своєю кінцевою продукцією. В результаті діяльності підприємств хімічного виробництва, а також використання продукції хімічної промисловості у повітря, воду, ґрунт потрапляє велика кількість отруйних речовин, які негативно впливають як на стан довкілля, так і на здоров’я людей. У районах високої концентрації хімічної промисловості внаслідок викидів і аварій переважає ситуація екологічної кризи. Найбільш небезпечними є велетенські хімічні підприємства, які більше викидають відходів, ніж дають продукції. Основними забруднювачами довкілля в процесі хімічного виробництва є оксиди Нітрогену, амоніак, чадний газ. Для подолання екологічних проблем, пов’язаних з хімічним виробництвом, слід переходити до сучасних маловідходних технологій виробництва, комплексно використовувати сировину, утилізувати виробничі відходи, запроваджувати сучасні системи очищення. Великою проблемою сьогодення стало надмірне застосування продукції хімічної промисловості у повсякденному житті, особливо з харчовими продуктами. Наслідки такого зловживання хімікатами мають бути ретельно досліджені.
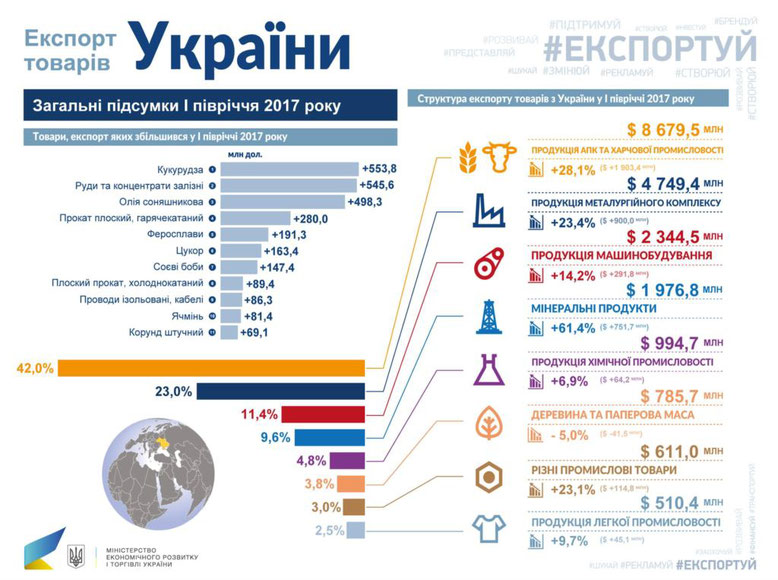
Місце хімічного виробництва у господарстві України. Хімічне виробництво є одним з найбільш розвинутих у національному господарстві України. Його важлива роль визначається широким застосуванням хімічних технологій і матеріалів у всіх сферах діяльності. Значна частина продукції хімічної промисловості використовується підприємствами інших виробництв як сировина і напівфабрикати: харчова та легка промисловість, медицина, будівництво, виробництво космічної техніки тощо.
Значний розвиток хімічної промисловості в Україні зумовлений трьома основними чинниками: природним (наявність різноманітної сировинної бази), економічним (необхідності повної переробки відходів, наявність споживача хімічної продукції) і соціальним (наявність наукової бази та кваліфікованої робочої сили). Окремі види продукції хімічної промисловості України (азотні добрива, самородна сірка, барвники, бром, титанові білила, деякі продукти органічного синтезу) експортуються до інших країн. Водночас хімічна промисловість створює для України складні екологічні проблеми. Недаремно в останні десятиліття взятий курс на виведення екологічно не безпечних хімічних виробництв за межі житлової забудови.
Хімічна промисловість в Україні має розгалужену виробничу структуру. Більшість її підприємств перебуває у приватній власності. Нині найбільшим власником хімічних виробництв є фінансово-промислова група Group DF, яка об’єднує підприємства, що виробляють органічні кислоти, титан діоксид, кальциновану соду, рідкий азот та інші хімічні продукти, контролює 4 з 6 українських виробництв азотних добрив. Модернізація та консолідація підприємств хімічної промисловості дали змогу дещо збільшити обсяги виробництва та вивести хімічну промисловість України на новий міжнародний рівень.
Гірничо-хімічна промисловість. В Україні є унікальні поклади гірничо-хімічної сировини, з яких нині видобувається лише незначна їх частина. Внаслідок різкого скорочення споживання калійних солей та самородної сірки у світі їх видобуток в Україні нині повністю припинений.
Видобуток кухонної солі останнім часом скоротився вдвічі. Найбільшим районом її видобутку є Донбас. Там працюють соляні копальні Бахмутівського та Слов’янського родовищ. Частину солі в Україні видобувають з морських розсолів затоки Сиваш Азовського моря.
Для потреб хімічного виробництва розробляються родовища вапняків на Донбасі та у Криму.
Виробництво неорганічних хімічних речовин. В Україні синтез неорганічних хімічних речовин набув значного рівня розвитку, хоча останнім часом його виробництва скоротили обсяги випуску своєї продукції у 2–3 рази.
Деякі виробництва були повністю зупинені. Виробництво неорганічних хімічних речовин в Україні переважно розвинуте на Донбасі та у Придніпров’ї. Це синтез соди, хлору, сірчаної кислоти, сажі, мінеральних добрив: азотних та фосфатних. Виробництво соди останнім часом суттєво скоротилося. Тривалий час основними виробниками харчової та кальцинованої соди були хімічні підприємства Слов’янська («Хімпром») та Лисичанська («Донсода»), які використовували для своєї роботи з другої половини ХІХ ст. місцеві сировину (кухонну сіль, вапняки) та паливо. Ці підприємства не лише забезпечували роботою місцевих жителів, а й катастрофічно забруднювали навколишнє середовище. Після свого закриття вони залишили по собі «місяцеві» ландшафти.
Виробництво технічних кальцинованої та каустичної соди нині збереглося у місті Яни Капу (до 2016 р. – Красноперекопськ) та Кримському содовому заводі. Він використовує розсоли затоки Сиваш та місцевий газ як паливо. Багаторічне скидання стічних вод заводу в місцеві озера зруйнувало їх екосистеми, зробило колись заповнені птахами береги пусткою. Каустичну соду також виробляють на підприємстві «ДніпроАЗОТ» у Кам’янському (до 2016 р. – Дніпродзержинськ), використовуючи місцеву електроенергію та сіль з Донбасу.
Виробництво хлору часто ґрунтується на використанні відходів содової промисловості. Його сполуки, що їх застосовують у виробництві мийних засобів та для знезаражування води, одержують у Кам’янському.
Хоча в останні роки обсяги сірчаної кислоти, що добувають в Україні, скоротилося у 1,5 раза, це виробництво й донині залишається одним з найважливіших в основній хімії нашої держави. Через високу хімічну активність кислоти її важко перевозити. Через те заводи з її виробництва тяжіють до споживача, основним з яких є виробництво фосфатних добрив. Тому в таких містах, як Одеса та Суми, ці два виробництва територіально поєднано. З відходів металургійних підприємств синтезують сірчану кислоту в Костянтинівці на Донеччині на державному хімічному заводі, а також у Кам’янському на підприємстві «ДніпроАЗОТ».
Сажу в Україні виробляють заводи технічного вуглецю у Кременчуку та Кадіївці (до 2016 р. – Стаханов). Їхня продукція, що відповідає світовим стандартам, експортується до країн Європи. Технічний вуглець (сажа) під вищує міцність гуми, яка йде на виробництво автомобільних шин.
Важливим в Україні є виробництво мінеральних добрив. Основна їх частина – це азотні (нітратні) добрива: аміачна селітра та карбамід. Україна забезпечує 3% світового експорту амоніаку і карбаміду. В нашій країні працюють підприємства, що належать до найбільших у Європі з даного профілю. Азотні добрива добувають з різної сировини. Старі центри виникли у районах чорної металургії й використовують як сировину відходи коксування вугілля – коксовий газ. Так одержують азотні добрива у Горлівці (концерн «Стирол»), Сєвєродонецькому об’єднанні «Азот», Кам’янському(«ДніпроАЗОТ»), Запоріжжі.
Інша група підприємств використовує як сировину природний газ, нафту та продукти їх переробки (амоніак), що надходять в Україну трубопроводами. До них належать Черкаський «Азот», який дає близько 1 /3 аміачної селітри, що використовується всередині країни. Подібний чинник розміщення має і підприємство «Рівнеазот». Одеський припортовий завод окрім виробництва амоніаку, карбаміду, рідкого азоту приймає та перевантажує призначені для експорту добрива, що виробляються в Україні та Росії. Завод є монополістом на загальнодержавному ринку спеціалізованих послуг з прийому, охолодження і перевантаження амоніаку.
Підприємства, що виробляють фосфорні добрива – суперфосфат, працюють на імпортній (Одеса, Суми) та місцевій (Костянтинівка) сировині.
Виробництво органічних хімічних речовин. Основним виробництвом хімії органічного синтезу в Україні є хімія полімерів. У державі налагоджене виробництво пластмас і синтетичних смол, синтетичного каучуку, хімічних волокон. Сировиною для їх виробництва є імпортні нафта, газ, а також кам’яне вугілля та продукти його коксування. Зазвичай ці хімічні підприємства розміщено у місцях споживання готової продукції. На їх розміщення також впливає значна потреба виробництва у воді та електроенергії.
Продукцію хімії органічного синтезу найбільше виробляють підприємства, що розміщені в Донбасі та Придніпров’ї. Так, у Запоріжжі виробляють органічні сполуки, пластмаси, синтетичні смоли; у Дніпрі – синтетичний каучук; у Кам’янському – полівініл та полістирол, у Сєвєродонецьку – вироби з пластмаси і склопластику.
В Україні синтезують хімічні волокна, які бувають штучними та синтетичними. Штучні волокна отримують з природних полімерів, переважно на основі переробки целюлози. До них належать ацетатні, віскозні й мідно-аміачні волокна). Синтетичні волокна виробляють із синтетичних смол. Це анід, капрон, лавсан, нітрон. Виробництво хімічних волокон налагоджене біля джерел води, електроенергії та споживача – текстильних підприємств. Кількість підприємств з виробництва хімічних волокон в Україні значно скоротилася. Нині діючі, що розміщені у Чернігові та Сєвєродонецьку, працюють не на повну потужність.
Зростає значення лакофарбової промисловості. Обсяги її виробництва збільшуються завдяки широким виробничим зв’язкам з різними виробництвами. Вона виробляє в Україні близько 2500 видів продукції. Найбільші лакофарбові заводи розташовані в Києві, Дніпрі, Запоріжжі, Кривому Розі, Одесі, Львові, Яни Капу та в інших містах країни. Розвивається виробництво синтетичних мийних засобів та парфумів. Серед продукції цих виробництв України відомі мило, косметичні засоби для макіяжу та догляду за шкірою, сонцезахисні та для засмаги, гоління, дезодоранти для тіла та антиреспіранти тощо.
Виробництва органічних хімічних речовин належать до наукомістких, тому розміщені переважно у великих містах – Дніпрі, Запоріж жі, Києві, Одесі, Харкові.
Виробництво фармацевтичних продуктів і препаратів. Динамічно розвивається хіміко-фармацевтична промисловість України. Вона об’єднує близько 160 різних підприємств колективної (77%), державної (18%) та приватної власності. Великих 22 виробники дають 85% загального обсягу вітчизняної продукції і основний асортимент вітчизняних ліків, посідають провідне місце у технічному переоснащенні, розробці та впровадженні у виробництво нових медичних препаратів. Серед основних виробників лікарських засобів в Україні є підприємства Києва: «Фармацевтична фірма «Дарниця» (майже 15% загальної вартості продукції), «Київмедпрепарат» (14,4%), «Фармак» (11%), «Борщагівка», «Індар», «Київський вітамінний завод». Серед інших міст фармацевтичною продукцією вирізняються Харків («Здоров’я»), Львів («Галичфарм»), Одеса («Біостимулятор»), Тернопіль, Умань.
Виробництво гумових виробів. Гумові вироби виробляє гумоазбестова промисловість. Найбільшими її підприємствами є «Дніпрошина» у Дніпрі та «Росава» у Білій Церкві. Вони випускають шини для легкових, вантажних автомобілів, дорожньобудівної та сільськогосподарської техніки. Потужності виробництва у Білій Церкві сягають майже 6 млн шин на рік. Асортимент продукції становить близько 200 типорозмірів шин. Шини забезпечують безпеку і комфорт на будь-якому дорожньому покритті не залежно від кліматичних умов. «Росава» постійно розробляє й виводить на ринок нові шини для всіх груп автотранспортних засобів, що можуть конкурувати на ринку. Розпочато випуск шин нового покоління, які мають зимовий малюнок протектора, та шини з можливістю шипування. Гумотехнічні вироби (труби, шланги, конвеєрні стрічки, гумове взуття) також випускають підприємства Лисичанська, Сум, Запоріжжя, Одеси, Харкова, Донецька, Чернівців.
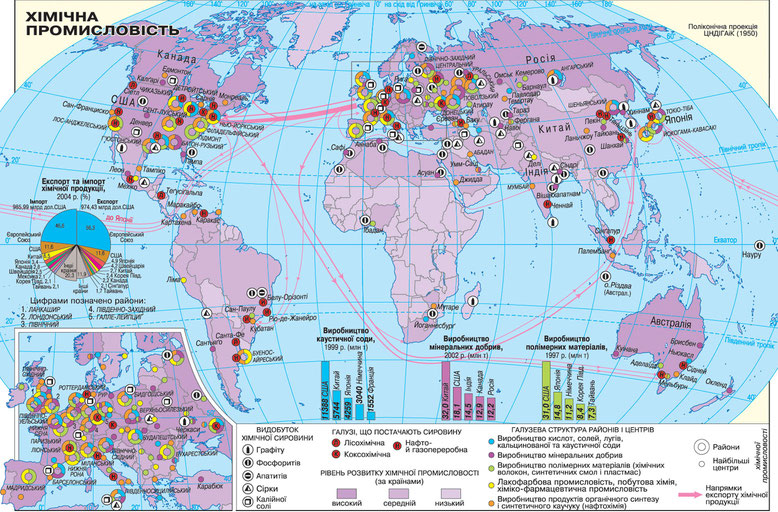
Хімічне виробництво світу. У світі хімічне виробництво розвивається стрімкими темпами. У розвинутих країнах за часткою в структурі промислового виробництва воно поступається тільки машинобудуванню. Відбувається процес хімізації – широке застосування хімічних матеріалів і технологій в усіх сферах господарства та побуті.
Головними регіонами її розвитку з практично однаковим значенням є Європа, Північна Америка, а також Східна, Південно-Східна та Південна Азія.
Найбільший регіон розвитку хімічного виробництва – Європа, на яку припадає близько 30% продукції цієї галузі. Швидкими темпами розвивається хімічне виробництво у Німеччині, Франції та Італії. Старі галузі (содова та мінеральних добрив) там зорієнтовані на сировину, нові (зокрема, нафтохімія), що працюють на імпортній сировині, тяжіють до морських портів. Хімічна промисловість Європи вирізняється значною наукомісткістю, переважають хімія полімерів, фармацевтична, парфумерна промисловість. У виробництві медикаментів світовими лідерами є Німеччина, Швейцарія, Велика Британія, Франція, Угорщина.
Північна Америка за розвитком хімічного виробництва майже не поступається Європі. США належать перші позиції у світі за синтезом полімерів, виробництвом фосфатних добрив, сірчаної кислоти. На узбережжі Мексиканської затоки склався найбільший у світі район нафтохімії. Канада є найбільшим у світі виробником калійних добрив, потужним виробником полімерів.
Третім регіоном високого розвитку хімічного виробництва є Східна, Південно-Східна та Південна Азія. Потужним осередком регіону є Японія, виробництво полімерів якої ґрунтується на імпортній сировині, а фармацевтична промисловість – на власній науковій базі. Швидкими темпами розвивається хімічна промисловість Китаю, яка спеціалізується переважно на виробництві мінеральних добрив: 34% усього виробництва світу та контроль 21% добрив на світовому ринку. Зростає роль хімічної промисловості Індії. Країна стала одним зі світових лідерів у виробництві азотних добрив та фармацевтичних препаратів. Роль азійського регіону у виробництві хімічної продукції постійно зростає: вже виробляється майже 3 /4 хімічних волокон світу, близько 1 /3 синтетичного каучуку та пластмас. В Азії з по чатку 90-х рр. ХХ ст. на основі нафтових родовищ формується новий регіон хімічної промисловості – Перська затока. Роль хімічного виробництва у світі й надалі зростатиме. У ній постійно вдосконалюються технологічні процеси, використовуються все більш різноманітна сировина та напівпродукти. Надалі відбуватиметься перехід від переважання основної хімії до хімії органічного синтезу. Перспективи розвитку хімічної індустрії мають бути спрямовані на більшу екологізацію виробництва.



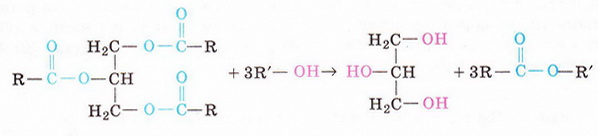
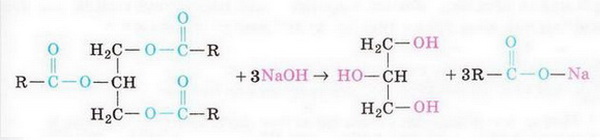
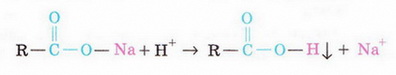



Комментариев нет:
Отправить комментарий