Ферум як представник металічних елементів побічних груп
Ферум – представник перехідних елементів, знаходиться у VIIIB підгрупі Періодичної системи хімічних елементів.
Електронна будова атома Феруму 1s22s22р63s23р63d64s2:
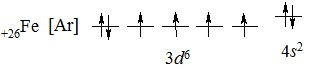
На зовнішньому електронному рівні атом Феруму містить два s-електрони, заповнюється 3d-підрівень, тому Ферум – d-елемент. У хімічних реакціях він віддає 2 електрони з 4s-підрівня з утворенням іона Fe2+, який при відщепленні одного електрона з 3d-підрівня утворює іон Fe3+. Менш характерним є ступінь окиснення +6. За рахунок вільних d-орбіталей Ферум утворює комплексні сполуки з координаційними числами 4, 6 і 8.
Назва “Ферум” походить від лат. “firmus” – міцний. Залізо – один з металів, відомий людству ще з ІХ – VII ст. Першим джерелом заліза були метеорити, згодом люди навчились виплавляти його з руд. У ті часи вартість міді, срібла, золота і заліза відносились як 1:160:1280:6400. Це було зумовлено, з одного боку, рідкістю метеоритного заліза і поширеністю самородних міді, срібла і золота, а з іншого – практичним застосуванням заліза для виготовлення зброї, сільськогосподарських інструментів тощо. В “Одисеї” Гомер згадує, як переможця спортивних ігор Ахіллеса нагородили шматком заліза і шматком золота.
Поширення в природі. Ферум – другий (після Алюмінію) за поширенням метал та четвертий (після Оксигену, Силіцію та Алюмінію) у земній корі (5,2%) елемент. Зустрічається у вільному стані (метеоритне залізо) та у вигляді сполук (табл. 24.1), які використовують для промислового одержання заліза.
Велика кількість самородного заліза (30%) метеоритного походження знаходиться на поверхні Місяця. Через відсутність там атмосфери з окисниками (кисень, вода) усі елементи перебувають у нижчих ступенях окиснення. При виверженні вулканів на Місяці утворюється самородне залізо шляхом відновлення мінералів за високої температури та глибокого вакууму.
Таблиця 24.1
Деякі природні сполуки Феруму
Назва мінералу
|
Формула
|
Бурий залізняк (лимоніт)
|
2Fe2O3∙3H2O
|
Залізний колчедан (пірит)
|
FeS2
|
Магнітний залізняк (магнетит)
|
Fe3O4 (або FeO∙Fe2O3; Fe(FeO2)2)
|
Червоний залізняк (гематит)
|
Fe2O3
|
Залізний шпат (сидерит)
|
FeСO3
|
Пірит рідко використовують для добування заліза, він є основною сировиною для одержання сульфатної кислоти.
Одержання. Сучасні промислові способи переробки залізних руд описані в п. Чавун і сталь.
Залізо високої чистоти одержують прямим відновленням Fe2O3:
Fe2O3 + 3H2 = Fe + 3H2O,
або термічним розкладом (150 – 200 0С, 10МПа) ферум пентакарбонілу:
[Fe(CO)5] = Fe + 5CO.
Фізичні властивості. Чисте залізо – сріблясто-білий метал, з хорошою тепло- та електропровідністю, пластичний, ковкий (табл. 24.2).
Таблиця 24.2
Деякі властивості Феруму і заліза
Характеристика
|
Ферум і залізо
|
Порядковий номер
|
26
|
Атомна маса
|
56
|
Конфігурація зовнішнього електронного рівня
|
3d64s2
|
Атомний радіус, пм
|
126
|
Густина, г/см3
|
7,87
|
Температура плавлення, 0С
|
1539
|
Температура кипіння, 0С
|
2870
|
На вологому повітрі залізо тьмяніє, утворюючи пухку плівку гідроксиду, яка не перешкоджає подальшому окисненню металу. Залізо виявляє феромагнітні властивості (речовини, що притягуються магнітом – феромагнетики). Механічні властивості заліза визначаються наявністю домішок, зі зростанням їх кількості якість металу погіршується.
Залізо утворює кілька кристалічних модифікацій, стійких за певної температури (після 768 0С залізо втрачає феромагнітні властивості):
При зниженні температури відбувається зворотній процес.
Хімічні властивості визначаються наявністю домішок. Чисте залізо – метал середньої активності. Біля м. Делі (Індія) стоїть залізна колона висотою 7 м і масою 6,5 т без жодних слідів корозії, хоча її вік – понад 2800 р. Колона виготовлена із заліза чистотою 99,72%, стійкого до корозії.
Для Феруму характерне утворення сполук Fe+2 i Fe+3, що відповідають оксидам FeO і Fe2O3. Відомі солі фератної кислоти H2FeO4, у яких ступінь окиснення Феруму +6.
І. Взаємодія з простими речовинами.
Залізо при нагріванні реагує з киснем, сіркою, галогенами, вуглецем та азотом з утворенням відповідних бінарних сполук:
3Fe + 2O2 = Fe3O4 (або FeO + Fe2O3); 2Fe + 3Cl2 = 2FeCl3;
Fe + S = FeS; 3Fe + C = Fe3C; 2Fe + N2 = 2FeN
З воднем залізо безпосередньо не реагує.
ІІ. Взаємодія зі складними речовинами.
1. Залізо за нормальних умов реагує з водою і киснем:
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Цей процес – корозія заліза детально розглянуто у п. Корозія металів.
2. Взаємодія з кислотами-неокисниками (HСl або розведена сульфатна) відбувається за нормальних умов і веде до утворення відповідних солей та виділення водню:
Fe + 2НСl = FeCl2 + Н2; Fe + Н2SO4 = FeSO4 + Н2.
3. Взаємодія з кислотами-окисниками (концентрована сульфатна, розбавлена та концентрована нітратна кислоти) веде до утворення солей Fe3+:
Fe + 4HNO3р. = Fe(NO3)3 + NO + H2O;
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Кислоти високих концентрацій пасивують метал, взаємодія не відбувається і тому концентровані HNO3 і H2SO4 перевозять у залізних цистернах.
4. Розпечене до червона залізо реагує з водяною парою:
3Fe + 4H2O = Fe3O4 + 4H2.
5. Залізо витісняє метали, які розташовані після нього у ряду стандартних електродних потенціалів з водних розчинів їх солей:
Fe + CuSO4 = FeSO4 + Cu.
Металічні руди
Природні сполуки металів називають мінералами. Природні мінеральні утворення, з яких технологічно можливо й економічно доцільно добувати метали, називають рудами. До складу руди крім корисних мінералів входить пуста порода (слово «руда» колись означало «кров»). Здебільшого вміст металів у рудах невисокий, тому руду попередньо збагачують (обробкою руди видаляють пусту породу, тому вміст корисної сполуки збільшується). Добутий після збагачення продукт називають концентратом
Загальні способи добування металів
Добуванням металів з руд займається металургія. Метали добувають з їхніх сполук на металургійних заводах.
Металургія – наука про промислові способи добування металів з природної сировини.
Залежно від способів добування металів розрізняють такі види металургії:
| Металургія | |||
| пірометалургія (відновлення оксидів вуглецем, воднем, CO при нагріванні) Cu2O + C = 2Cu + CO2 | металотермія відновлення оксидів іншими металами: Al, Mg, Ca, Na, Si. Cr2O3+2Al = 2Cr + Al2O3. | гідрометалургія добування із розчинів солей: CuO + H2SO4 = CuSO4 + H2O; CuSO4 + Fe = Cu + FeSO4. | електрометалургія електроліз MexRy, MexOy, Me(OH)y. 2Al2O3 |
Пірометалургія посідає провідне місце в металургії. Цим способом добувають метали з руд за допомогою реакцій відновлення, які проводять при високих температурах. Як відновники застосовують вугілля, водень, карбон(II) оксид, активні метали.
Добування металів
1. Випалювання сульфідів та відновлення металів з їх оксидів
2. Електроліз розчинів і розплавів
|
а) Сульфідні руди спочатку випалюють: 2ZnS + 3O2 = 2ZnO + 2SO2, а потім добутий основний оксид відновлюють вугіллям (коксом): ZnO + C → Zn + CO.
б) Оксидні руди найчастіше відновлюють коксом або карбон(II) оксидом, рідше воднем:
2ZnO + C → 2Zn + CO2
Fe2O3 + 3CO → 2Fe + 3CO2
MoO3 + 3H2 → Mo + 3H2O
2ZnO + C → 2Zn + CO2
Fe2O3 + 3CO → 2Fe + 3CO2
MoO3 + 3H2 → Mo + 3H2O
Відновлення металів з їх сполук іншими металами, хімічно більш активними, називають металотермією, або неметалами (силікотермія):
3MnO2 + 4Al 3Mn + 2Al2O3 (алюмотермія) 2MgO + Si → 2Mg + SiO2.
3Mn + 2Al2O3 (алюмотермія) 2MgO + Si → 2Mg + SiO2.
3MnO2 + 4Al
Гідрометалургія охоплює способи добування металів з розчинів їх солей. При цьому метал, що входить до складу руди, спочатку переводять у розчин за допомогою відповідних реагентів, а потім добувають його з цього розчину. Так, наприклад, під час обробки мідної руди розбавленою сульфатною кислотою, наявний у руді CuO переходить у розчин у вигляді сульфату. Мідь із солі добувають електролізом або відновленням за допомогою порошку заліза.
Електрометалургія охоплює способи добування металів за допомогою електролізу. Електролізом добувають чисті метали. Найактивніші метали (наприклад, Na, K, Ca, Mg) добувають електролізом розплавів солей. Менш активні метали – електролізом розчинів солей.
Метали і сплави у сучасній техніці
У техніці використовують переважно не чисті метали, а сплави, бо чисті метали здебільшого не мають усіх властивостей, необхідних для практичного застосування. Алюміній – легкий, але неміцний метал, який не має достатньої твердості. Щоб підвищити твердість і міцність алюмінію, добувають його сплав з такими металами, як мідь, магній, марганець. Золото гарне, але дуже пластичне. Вироби з чистого золота легко деформуються, стираються, тому для виготовлення ювелірних виробів застосовують сплав золота з міддю
Метали в розплавленому стані розчиняються один в одному і при охолодженні утворюється твердий розчин – або сплав.
Сплави – це системи із двох або більше металів, а також металів і неметалів.
Основою сплавів служать такі метали як залізо, мідь, алюміній, магній, титан. Із неметалів важливими компонентами є вуглець, бор, кремній та ін.
Метали у сплавах можуть:
а) розчинятися один в одному, якщо сплавляються близькі за властивостями метали, то у вузлах їхніх кристалічних ґраток містяться атоми різних металів, такий сплав називають твердим розчином;
б) утворювати механічні суміші, якщо сплавляються метали, які відрізняються за хімічними властивостями, то при твердінні утворюється маса, що складається з найдрібніших кристаликів кожного з металів;
в) реагувати один з одним з утворенням сполук – інтерметалідів. Здатність металів у розплавленому стані не тільки механічно змішуватися, а й утворювати між собою і з атомами неметалів різні сполуки – одна з причин, яка пояснює, чому фізичні властивості сплавів різко відрізняються від фізичних властивостей металів, що утворюють сплав.
а) розчинятися один в одному, якщо сплавляються близькі за властивостями метали, то у вузлах їхніх кристалічних ґраток містяться атоми різних металів, такий сплав називають твердим розчином;
б) утворювати механічні суміші, якщо сплавляються метали, які відрізняються за хімічними властивостями, то при твердінні утворюється маса, що складається з найдрібніших кристаликів кожного з металів;
в) реагувати один з одним з утворенням сполук – інтерметалідів. Здатність металів у розплавленому стані не тільки механічно змішуватися, а й утворювати між собою і з атомами неметалів різні сполуки – одна з причин, яка пояснює, чому фізичні властивості сплавів різко відрізняються від фізичних властивостей металів, що утворюють сплав.
Нині деякі сплави готують методом порошкової металургії. Беруть суміш металів у вигляді порошків, пресують її під великим тиском і спікають при високій температурі у відновлювальному середовищі. Таким способом отримують надтверді сплави.
Сплави за фізичними властивостями відрізняються від вихідних металів: вони тверді, гірше проводять електричний струм і теплоту. Як правило домішки знижують температуру плавлення твердих тіл, тому сплави плавляться при нижчій температурі, як чисті метали. Температура плавлення свинцю 328°C, олова 232°C, а сплав свинцю (1 частина) і олова (2 частини) плавиться при 181°C, тобто значно нижчій температурі, як чисті метали.
Сплав, що складається з Міді (99%) і берилію (1%) твердіший за мідь у сім разів. Відомо, що цинк, мідь і алюміній за звичайних умов не взаємодіють з водою.
Сплав, що складається з Міді (99%) і берилію (1%) твердіший за мідь у сім разів. Відомо, що цинк, мідь і алюміній за звичайних умов не взаємодіють з водою.
Сплав, який містить мідь (50%), алюміній (45%) і цинк (5%), за таких умов вступає в реакцію з водою з виділенням водню.
Домішки металів затрудняють переміщення вільних електронів внаслідок чого знижується електропровідність металів.
Сплави бувають тверді та м’які, тугоплавкі, легкоплавкі, жаростійкі, кислотостійкі, стійкі до дій лугів.
Сучасна техніка використовує більше 5000 сплавів. Особливо виділяються алюмінієві сплави:
1) дюралюміни (від французького слова dur – твердий і aluminium – твердий алюміній). Дюралюміни в своєму складі можуть містити: а) 1,4-13% Cu; б) 0,4-2,8% Mg; в) 0,2-1% Mn; г) 5-7% Zn; д) 0,8-1,8%Fe; е) 0,02-0,35% Ti, іноді 0,5-6% Si. Дюралюміни міцні і легкі, теплопровідні, корозійно стійкі використовують в авіабудуванні для виготовлення деталей турбореактивних двигунів;
2) магналії – сплави алюмінію з великим вмістом магнію (5-13%), Mn (0,2-1,6%), Ni (1,75-2,25%), Be (до 0,15%), Ti (до 0,2%), Zr (0,2%) іноді Zn (3,5-4,5%). Магналій відрізняються високою міцністю і стійкістю до корозії в прісній і навіть в морській воді, стійкі до кислот. Застосовують для виготовлення арматури будівельних споруд, деталей холодильних установок, декоративних побутових предметів, в авіа-, судно- і машинобудуванні;
3) силуміни – сплави на основі алюмінію з високим вмістом Si. До складу силумінів входять: Si (3-26%), Cu (1-4%), Mg (0,2-1,5%), Mn (0,2-0,9%), Ni (0,8-2%) іноді Zn (2-4%), Cr (0,1-0,4%), Ti (0,05-1,5%) та ін. Силуміни використовують в авіабудуванні, вагонобудуванні, автомобілебудуванні, будівництві сільськогосподарських машин, деталі коліс, корпусів і деталей приладів;
4) САП – сплав Al і Al2O3 (20-22%) володіє підвищеною стійкістю до окиснення, незмінний там, де температура експлуатації перевищує 400°C.
1) дюралюміни (від французького слова dur – твердий і aluminium – твердий алюміній). Дюралюміни в своєму складі можуть містити: а) 1,4-13% Cu; б) 0,4-2,8% Mg; в) 0,2-1% Mn; г) 5-7% Zn; д) 0,8-1,8%Fe; е) 0,02-0,35% Ti, іноді 0,5-6% Si. Дюралюміни міцні і легкі, теплопровідні, корозійно стійкі використовують в авіабудуванні для виготовлення деталей турбореактивних двигунів;
2) магналії – сплави алюмінію з великим вмістом магнію (5-13%), Mn (0,2-1,6%), Ni (1,75-2,25%), Be (до 0,15%), Ti (до 0,2%), Zr (0,2%) іноді Zn (3,5-4,5%). Магналій відрізняються високою міцністю і стійкістю до корозії в прісній і навіть в морській воді, стійкі до кислот. Застосовують для виготовлення арматури будівельних споруд, деталей холодильних установок, декоративних побутових предметів, в авіа-, судно- і машинобудуванні;
3) силуміни – сплави на основі алюмінію з високим вмістом Si. До складу силумінів входять: Si (3-26%), Cu (1-4%), Mg (0,2-1,5%), Mn (0,2-0,9%), Ni (0,8-2%) іноді Zn (2-4%), Cr (0,1-0,4%), Ti (0,05-1,5%) та ін. Силуміни використовують в авіабудуванні, вагонобудуванні, автомобілебудуванні, будівництві сільськогосподарських машин, деталі коліс, корпусів і деталей приладів;
4) САП – сплав Al і Al2O3 (20-22%) володіє підвищеною стійкістю до окиснення, незмінний там, де температура експлуатації перевищує 400°C.
Широко застосовуються сплави на основі міді – латуні і бронзи. Латунь містить до 45% цинку (проста латунь). Спеціальні латуні крім міді і цинку містять залізо, алюміній, олово, кремній. З неї виготовляють труби для конденсаторів і радіаторів, деталі механізмів, в суднобудуванні завдяки високій корозійній стійкості. Латунь з високим вмістом міді через свою подібність до золота використовують для ювелірних і декоративних виробів.
Бронза – це сплави міді з іншими речовинами: Cu–Sn, Cu–Al (5-10%), Cu–Pb (33%), Cu–Si (4%) використовують для виготовлення деталей машин, посуду. Для виготовлення електронагрівальних приладів використовують сплав ніхром (Ni (67%), Cr (15%), Fe (16%), Mn (1,5%)).
Для авіації застосовують легкі сплави за основі магнію, титану, алюмінію. Для металообробної промисловості з використанням вольфраму, кобальту, нікелю. В електротехніці – сплави на основі міді. Потужні магніти – продукти взаємодії Кобальту, Самарію та інших рідкоземельних елементів. Для машинобудування необхідні сплави легкі, нерозчинні в кислотах, стійкі в агресивних газових середовищах, теплопровідні, магнітні або немагнітні. Для медицини, зокрема хірургії і протезування, крім стійкості до мікроорганізмів, окиснення, сплави повинні «зростатися» з людським організмом.
Застосування сплавів
- Літако–, ракето–, авто–, суднобудування.
- Виготовлення швидкоріжучих інструментів, конструкційні матеріали стійкі до агресивних середовищ, феромагнітні вироби.
- Виготовлення дробильних установок, залізничних рейок, автомобільних осей.
- Виготовлення монет, предметів домашнього вжитку, золочення, виробництво дзеркал, ювелірні вироби, зубні протези.
- Виготовлення трансформаторів, хімічної апаратури, лабораторного посуду, декоративно-прикладні вироби, скульптури.
- Виготовлення ниток електроламп, деталей електронагрівачів.
Чавун і сталь
Найбільше значення у сучасній техніці мають сплави заліза з вуглецем, а не чисте залізо. Залежно від кількісного вмісту вуглецю сплавам дали назви чавун або сталь.
Чавун – це сплав заліза, в якому міститься більше 1,7% Карбону, а також домішки Силіцію, Мангану, Сульфуру, Фосфору. Він твердіший за залізо, крихкий, не піддається куванню і прокатуванню і розбивається внаслідок удару.
Розрізняють два види чавуну: сірий і білий.
Сірий чавун (ливарний) містить Карбон у вигляді графіту і на зломі має сірий колір. У техніці він застосовується для відливання важких частин машин, маховиків, плит, труб, ґрати для мостів, хімічної апаратури.
Білий чавун (переробний) містить Карбон у складі цементиту Fe3C світліший за сірий. Цей чавун переробляють на сталь.
Домішки Сульфуру надають чавуну червоноломкість (виникнення тріщин при гарячій механічній обробці), а Фосфору – холодноломкість (крихкість при обробці за звичайних умов).
Сталь – це сплав залізо, вміст Карбону в якому від 0,3 до 1,7%.
Сталь на відміну від чавуну легко піддається куванню і прокатуванню. При швидкому охолодженні вона виходить дуже твердою, при повільному – м’якою. М’яку сталь легко обробляти. Конструкційні сталі мають високу міцність і пластичність, добре обробляються тиском, різанням, зварюються. Інструментальні сталі мають високу міцність, твердість, стійкі до корозії. З них виготовлять деталі газових турбін, реактивних двигунів, ракетних установок. З магнітних сталей роблять магнітне обладнання.
Для добування легованих сталей, до них додають легуючі елементи, які надають сталі певних властивостей, підвищують твердість і температуростійкість. Так, хромомолібденові і хромованадієві сталі застосовують для виготовлення трубопроводів і деталей компресорів у реактивних двигунах, що працюють при високому тиску і температурі. З хромовольфрамових сталей виготовляють інструменти, які працюють при великих швидкостях і високих температурах. Марганцевисті сталі дуже стійкі до тертя та удару. Хромонікелеві сталі мають високу механічну міцність, жаростійкі та стійкі проти корозії, з них виготовляють деталі машин та предмети домашнього вжитку.
Лабораторний дослід 15. Ознайомлення зі зразками сплавів металів
Ознайомтеся із зовнішнім виглядом, кольором, ковкістю, пластичністю виданих вам зразків сплавів металів. Назвіть галузі їх застосування.

Комментариев нет:
Отправить комментарий